Änderung Anhang 2 BioAbfV vom 01.05.2012
Ähnliche Seiten: weitere Fassungen von Anhang 2 BioAbfV, alle Änderungen durch Artikel 1 BioAbfVuaÄndV am 1. Mai 2012 und Änderungshistorie der BioAbfVHervorhebungen: alter Text, neuer Text
Änderung verpasst?
| Anhang 2 BioAbfV a.F. (alte Fassung) in der vor dem 01.05.2012 geltenden Fassung | Anhang 2 BioAbfV n.F. (neue Fassung) in der am 01.05.2012 geltenden Fassung durch Artikel 1 V. v. 23.04.2012 BGBl. I S. 611 |
|---|---|
(Text alte Fassung) Anhang 2 Seuchen- und phytohygienische Unbedenklichkeit | (Text neue Fassung)Anhang 2 (zu § 2 Nummer 2, § 3 Absatz 2 bis 7) Anforderungen an die hygienisierende Behandlung von Bioabfällen zur Gewährleistung der seuchen- und phytohygienischen Unbedenklichkeit |
| | Inhaltsverzeichnis 1 Allgemeine Anmerkungen 2 Hygienisierende Behandlung 2.1 Behandlungsverfahren zur Hygienisierung (zu § 2 Nummer 2) 2.2 Anforderungen an die hygienisierende Behandlung 2.2.1 Pasteurisierung 2.2.1.1 Anforderungen an die Prozessführung 2.2.1.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 2.2.1.3 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) 2.2.1.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) 2.2.2 Aerobe hygienisierende Behandlung (thermophile Kompostierung) 2.2.2.1 Anforderungen an die Prozessführung 2.2.2.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 2.2.2.3 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) 2.2.2.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) 2.2.3 Anaerobe hygienisierende Behandlung (thermophile Vergärung) 2.2.3.1 Anforderungen an die Prozessführung 2.2.3.2 Ermittlung der Mindestverweilzeit 2.2.3.3 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 2.2.3.4 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) 2.2.3.5 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) 2.2.4 Anderweitige hygienisierende Behandlung 2.2.4.1 Anforderungen an die Prozessführung 2.2.4.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 2.2.4.3 Prozessüberwachung (§ 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) 2.2.4.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) 3 Prüfungen der seuchen- und phytohygienischen Unbedenklichkeit 3.1 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 3.1.1 Allgemeine Anforderungen 3.1.2 Anlagen zur aeroben hygienisierenden Behandlung (thermophile Kompostierungsanlagen) 3.1.2.1 Mietenkompostierung 3.1.2.2 Andere Kompostierungsverfahren 3.1.3 Anlagen zur anaeroben hygienisierenden Behandlung (thermophile Vergärungsanlagen) 3.2 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) 3.3 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) 4 Methoden zur Prüfung der seuchen- und phytohygienischen Unbedenklichkeit 4.1 Traceruntersuchungen zur Ermittlung der Mindestverweilzeit bei anaeroben hygienisierenden Behandlungsverfahren (thermophile Vergärung) 4.1.1 Traceruntersuchung mit Sporen von Bacillus globigii 4.1.1.1 Vorbereitung 4.1.1.2 Durchführung der Untersuchung 4.1.1.3 Nachweismethode 4.1.1.4 Mindestverweilzeit 4.1.2 Traceruntersuchung mit Lithium 4.1.2.1 Vorbereitung 4.1.2.2 Durchführung der Untersuchung 4.1.2.3 Nachweismethode 4.1.2.4 Mindestverweilzeit 4.2 Prüfungen der Seuchenhygiene 4.2.1 Prozessprüfung 4.2.1.1 Testorganismus und Grenzwert 4.2.1.2 Einlageproben für aerobe hygienisierende Verfahren (thermophile Kompostierung) 4.2.1.3 Einlageproben für anaerobe hygienisierende Verfahren (thermophile Vergärung) 4.2.1.4 Nachweismethode 4.2.2 Prüfungen der hygienisierten Bioabfälle 4.3 Prüfungen der Phytohygiene 4.3.1 Prozessprüfung 4.3.1.1 Testorganismen und Grenzwerte 4.3.1.2 Testorganismus Plasmodiophora brassicae 4.3.1.2.1 Herstellung der Einlageproben für aerobe hygienisierende Behandlungsverfahren (thermophile Kompostierung) 4.3.1.2.2 Herstellung der Einlageproben für anaerobe hygienisierende Behandlungsverfahren (thermophile Vergärung) 4.3.1.2.3 Nachweis der Infektiosität durch einen Biotest 4.3.1.3 Testorganismus Tomatensamen 4.3.1.3.1 Herstellung der Einlageprobe 4.3.1.3.2 Bestimmung der Keimrate durch einen Biotest 4.3.1.4 Testorganismus Tabakmosaikvirus bei aeroben hygienisierenden Behandlungsverfahren (thermophile Kompostierung) 4.3.1.4.1 Herstellung der Einlageproben 4.3.1.4.2 Nachweis der Infektiosität durch einen Biotest 4.3.2 Prüfungen der hygienisierten Bioabfälle |
(Textabschnitt unverändert) 1 Allgemeine Anmerkungen | |
| In diesem Anhang sind die Anforderungen zur Prüfung der seuchen- und phytohygienischen Unbedenklichkeit für Produkte nach einer biologischen Behandlung (Aerobbehandlung/Kompostierung und Anaerobbehandlung/Vergärung) enthalten. Die seuchen- und phytohygienische Unbedenklichkeit von Produkten aus der biologischen Abfallbehandlung wird durch Prozeß- und Produktprüfungen festgestellt. | In diesem Anhang sind die Anforderungen und die Vorgaben an die hygienisierende Behandlung (Anlagen und Verfahren) und Prüfungen der hygienisierten Bioabfälle beschrieben. Werden Bioabfälle einer Behandlung zugeführt, die den Anforderungen an die Hygienisierung nicht entspricht (z. B. mesophile Vergärung), ist die hygienisierende Behandlung der Bioabfälle nach den Vorgaben dieses Anhangs zusätzlich durchzuführen. Die Anlage ist so zu führen und die Behandlung ist so durchzuführen, dass eine Rekontamination der hygienisierend behandelten Materialien vermieden wird. 2 Hygienisierende Behandlung 2.1 Behandlungsverfahren zur Hygienisierung (zu § 2 Nummer 2) Die hygienisierende Behandlung der Bioabfälle erfolgt durch a) Pasteurisierung (Nummer 2.2.1), b) aerobe hygienisierende Behandlung (thermophile Kompostierung) (Nummer 2.2.2), c) anaerobe hygienisierende Behandlung (thermophile Vergärung) (Nummer 2.2.3) oder d) anderweitige Hygienisierungsbehandlung (Nummer 2.2.4). 2.2 Anforderungen an die hygienisierende Behandlung 2.2.1 Pasteurisierung Die Pasteurisierung kann vor oder nach einer zusätzlichen, insbesondere biologisch stabilisierenden Behandlung (z. B. mesophile Vergärung) durchgeführt werden. 2.2.1.1 Anforderungen an die Prozessführung Vor der Pasteurisierung sind die Bioabfälle auf eine Teilchengröße mit einer Kantenlänge (zweidimensional) von jeweils maximal 12 mm zu zerkleinern. Das Material ist bei der Erhitzung zu homogenisieren und muss einen Wassergehalt aufweisen, der einen hinreichenden Wärmeübergang zwischen und innerhalb der Teilchen gewährleistet. Die Prozesssteuerung in Pasteurisierungsanlagen muss für die Hygienisierung der Bioabfälle so vorgenommen werden, dass eine Temperatur von mindestens 70 °C über einen zusammenhängenden Zeitraum von mindestens 1 Stunde auf das gesamte Material einwirkt. 2.2.1.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) Für Pasteurisierungsanlagen ist keine Prozessprüfung gemäß Nummer 3.1 erforderlich; stattdessen sind Pasteurisierungsanlagen vor der Inbetriebnahme durch die zuständige Behörde, ggf. unter Hinzuziehung eines Sachverständigen, technisch abzunehmen (§ 3 Absatz 5 Satz 3). Die zuständige Behörde stellt eine Abnahmebescheinigung aus, wenn sie festgestellt hat, dass die Pasteurisierungsanlage die Anforderungen an die Prozessführung nach Nummer 2.2.1.1 erfüllt und mit den erforderlichen Einrichtungen und Geräten ausgestattet ist, insbesondere mit a) Geräten zur Überwachung der Temperatur, b) Geräten zur ständigen Aufzeichnung der Messergebnisse und c) einem angemessenen Sicherheitssystem zur Vermeidung einer unzulänglichen Erhitzung. 2.2.1.3 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) Die Prozessüberwachung ist nach den Vorgaben der Nummer 3.2 durchzuführen. 2.2.1.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) Die Prüfungen der hygienisierten Bioabfälle sind nach den Vorgaben der Nummer 3.3 und den Methoden gemäß Nummer 4.2.2 (Seuchenhygiene) und Nummer 4.3.2 (Phytohygiene) durchzuführen. 2.2.2 Aerobe hygienisierende Behandlung (thermophile Kompostierung) 2.2.2.1 Anforderungen an die Prozessführung Die Prozesssteuerung in Kompostierungsanlagen muss für die Hygienisierung der Bioabfälle so vorgenommen werden, dass über mehrere Wochen ein thermophiler Temperaturbereich und eine hohe biologische Aktivität bei günstigen Feuchte- und Nährstoffverhältnissen sowie eine optimale Struktur und Luftführung gewährleistet sind. Der Wassergehalt soll mindestens 40 % betragen und der pH-Wert um 7 liegen. Im Verlauf der aeroben hygienisierenden Behandlung muss eine Temperatur von mindestens 55 °C über einen möglichst zusammenhängenden Zeitraum von 2 Wochen, von 60 °C über 6 Tage oder von 65 °C über 3 Tage auf das gesamte Rottematerial einwirken. 2.2.2.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) Für Kompostierungsanlagen zur Hygienisierung ist die Prozessprüfung nach den Vorgaben der Nummer 3.1.1 und der Nummer 3.1.2 durchzuführen. Zur Verwendung von Testorganismen (Test- und Indikatorkeime) und zur Prüfung ihrer Abtötung oder Inaktivierung sind folgende Methoden anzuwenden: a) für die Seuchenhygiene die Methoden gemäß Nummer 4.2.1 (außer Nummer 4.2.1.3) und b) für die Phytohygiene die Methoden gemäß Nummer 4.3.1 (außer Nummer 4.3.1.2.2). 2.2.2.3 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) Die Prozessüberwachung ist nach den Vorgaben der Nummer 3.2 durchzuführen. 2.2.2.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) Die Prüfungen der hygienisierten Bioabfälle sind nach den Vorgaben der Nummer 3.3 und den Methoden gemäß Nummer 4.2.2 (Seuchenhygiene) und Nummer 4.3.2 (Phytohygiene) durchzuführen. 2.2.3 Anaerobe hygienisierende Behandlung (thermophile Vergärung) 2.2.3.1 Anforderungen an die Prozessführung Die Prozesssteuerung in Vergärungsanlagen muss für die Hygienisierung der Bioabfälle so vorgenommen werden, dass über den zusammenhängenden Zeitraum der Mindestverweilzeit die Behandlungstemperatur im thermophilen Bereich (mindestens 50 °C) auf das gesamte Material einwirkt. Hierbei dürfen die bei der bestandenen Prozessprüfung (s. Nummer 2.2.3.3) verwendete technisch vorgegebene oder nachgewiesene Mindestverweilzeit (s. Nummer 2.2.3.2) und die verwendete Behandlungstemperatur nicht unterschritten werden. 2.2.3.2 Ermittlung der Mindestverweilzeit Sofern die Mindestverweilzeit im Fermenter nicht technisch mittels einer hydraulischen Absperrung innerhalb der Beschickungs- und Entnahmeintervalle vorgegeben ist, muss sie durch eine Traceruntersuchung nach einer Methode gemäß Nummer 4.1 vor der Prozessprüfung (s. Nummer 2.2.3.3) nachgewiesen werden. Mit der Traceruntersuchung wird diejenige Zeitspanne an der Vergärungsanlage zur Hygienisierung ermittelt, die alle Substratteile (fest und flüssig) als kürzeste Aufenthaltszeit im Fermenter haben. Dabei wird das zu vergärende Substrat vor der Zugabe in den Fermenter mit Indikatoren (Tracer) markiert. Die Mindestverweilzeit des zu vergärenden Materials im Fermenter ist die Zeitspanne, die bis zur letzten Probe ohne Befund vor erstmaligem Nachweis des Tracers ermittelt wurde. Bis zum Vorliegen der Ergebnisse der Traceruntersuchung darf bei der Anlage die vom Anlagenhersteller und -planer berechnete Mindestverweildauer nicht unterschritten werden. Damit die Mindestverweildauer nicht unterschritten wird, darf nach Erreichen des Sollfüllstandes in dem für die Hygienisierung relevanten Fermenter die vom Anlagenhersteller und -planer ermittelte maximale tägliche Inputmenge nicht dauerhaft überschritten werden. Liegt eine entsprechende Berechnung nicht vor, ist sie in Abstimmung mit der zuständigen Behörde zu erstellen, ggf. unter Hinzuziehung eines Sachverständigen. 2.2.3.3 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) Für Vergärungsanlagen zur Hygienisierung ist die Prozessprüfung nach den Vorgaben der Nummer 3.1.1 und der Nummer 3.1.3 durchzuführen. Bei der Prozessprüfung ist eine im thermophilen Temperaturbereich (mindestens 50 °C) erforderliche Behandlungstemperatur zu verwenden. Die Prozessprüfung ist mit der technisch vorgegebenen oder nachgewiesenen Mindestverweilzeit (s. Nummer 2.2.3.2) durchzuführen. Zur Verwendung von Testorganismen (Test- und Indikatorkeime) und zur Prüfung ihrer Abtötung oder Inaktivierung sind folgende Methoden anzuwenden: a) für die Seuchenhygiene die Methoden gemäß Nummer 4.2.1 (außer Nummer 4.2.1.2) sowie b) für die Phytohygiene die Methoden gemäß Nummer 4.3.1.1 (außer Testorganismus Tabakmosaikvirus gemäß Buchstabe c), Nummer 4.3.1.2 (außer Nummer 4.3.1.2.1) und Nummer 4.3.1.3. Wird die Prozessprüfung nicht bestanden, ist sie mit einer höheren Behandlungstemperatur oder verlängerten Mindestverweilzeit zu wiederholen. 2.2.3.4 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) Die Prozessüberwachung ist nach den Vorgaben der Nummer 3.2 durchzuführen. 2.2.3.5 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) Die Prüfungen der hygienisierten Bioabfälle sind nach den Vorgaben der Nummer 3.3 und den Methoden gemäß Nummer 4.2.2 (Seuchenhygiene) und Nummer 4.3.2 (Phytohygiene) durchzuführen. 2.2.4 Anderweitige hygienisierende Behandlung Für ein anderweitiges hygienisierendes Behandlungsverfahren ist, ggf. unter Hinzuziehung eines Sachverständigen, die gleichwertige Wirksamkeit der Hygienisierung gemessen an den Anforderungen dieses Anhangs nachzuweisen (§ 3 Absatz 3 Satz 4). 2.2.4.1 Anforderungen an die Prozessführung Die Anforderungen an die Prozessführung zur hygienisierenden Behandlung der Bioabfälle sind in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, so zu bestimmen und zu beschreiben, dass ein gleichwertiges Hygienisierungsniveau erreicht wird. 2.2.4.2 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) Die Anforderungen an die Prozessprüfung sind in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, so zu bestimmen und zu beschreiben, dass ein gleichwertiges Hygienisierungsniveau unter Berücksichtigung der Vorgaben der Nummer 3.1.1 sowie der Methoden gemäß Nummer 4.2.1 (Seuchenhygiene) und Nummer 4.3.1 (Phytohygiene) erreicht wird. 2.2.4.3 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) Die Anforderungen an die Prozessüberwachung sind in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, so zu bestimmen und zu beschreiben, dass ein gleichwertiges Hygienisierungsniveau unter Berücksichtigung der Vorgaben der Nummer 3.2 erreicht wird. 2.2.4.4 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) Die Prüfungen der hygienisierten Bioabfälle sind nach den Vorgaben der Nummer 3.3 und den Methoden gemäß Nummer 4.2.2 (Seuchenhygiene) und Nummer 4.3.2 (Phytohygiene) durchzuführen. 3 Prüfungen der seuchen- und phytohygienischen Unbedenklichkeit Die hygienische Unbedenklichkeit der Bioabfälle wird festgestellt mit Hilfe der a) Prozessprüfung gemäß § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5 und nach Maßgabe der Beschreibungen in Nummer 3.1, b) Prozessüberwachung gemäß § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6 und nach Maßgabe der Beschreibungen in Nummer 3.2 und c) Prüfungen der hygienisierten Bioabfälle gemäß § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a und nach Maßgabe der Beschreibungen in Nummer 3.3. |
Die seuchen- und phytohygienischen Untersuchungen sind nach Möglichkeit gleichzeitig durchzuführen. | |
Die Grundsätze der Betriebshygiene zur Vermeidung einer Rekontamination der Produkte sind in jedem Fall zu beachten. 2 Prüfvorgaben 2.1 Anforderungen an die Prozeßführung Die Prozeßsteuerung in Kompostierungsanlagen muß so erfolgen, daß über einen Zeitraum von mehreren Wochen ein thermophiler Temperaturbereich und eine hohe biologische Aktivität bei günstigen Feuchte- und Nährstoffverhältnissen sowie eine optimale Struktur und Luftführung gewährleistet sind. Der Wassergehalt soll mindestens 40 % betragen und der pH-Wert um 7 liegen. Im Kompostierungsverfahren muß im Verlauf der Kompostierung eine Temperatur von mindestens 55 °C über einen möglichst zusammenhängenden Zeitraum von 2 Wochen oder von 65 °C (bei geschlossenen Anlagen: 60 °C) über 1 Woche im gesamten Mischgut einwirken. In Vergärungsanlagen muß die Abfallmatrix so behandelt werden, daß eine Mindesttemperatur von 55 °C über einen zusammenhängenden Zeitraum von 24 Stunden sowie eine hydraulische Verweilzeit im Reaktor von mindestens 20 Tagen erreicht wird. Bei niedrigeren Betriebstemperaturen oder kürzerer Einwirkungszeit muß entweder eine thermische Vorbehandlung der Inputmaterialien (70 °C; 1 Stunde) oder eine entsprechende Nachbehandlung der Produkte (Erhitzung auf 70 °C; 1 Stunde) bzw. eine aerobe Nachrotte der separierten Gärrückstände (Kompostierung) durchgeführt werden; Wirtschaftsdünger in landwirtschaftlichen Kofermentationsanlagen (einzelbetriebliche und Gemeinschaftsanlagen) bleiben davon unberührt, soweit Bestimmungen des Tierseuchenrechts dem nicht entgegenstehen. Noch nicht hygienisierte Inputmaterialien sind so aufzubewahren, daß sie nicht mit bereits erhitzten, kompostierten oder vergorenen Materialien in Berührung kommen können. Für eine hinreichende Überwachung des Behandlungsprozesses müssen für die Einlage und Entnahme von Proben Öffnungen in den Anlagen zur Behandlung biologisch abbaubarer Abfälle vorhanden sein. 2.2 Prüfung der seuchen- und phytohygienischen Unbedenklichkeit Die hygienische Unbedenklichkeit von Produkten aus der biologischen Abfallbehandlung wird mit Hilfe von direkten (Nr. 2.2.1) und indirekten (Nr. 2.2.2) Prozeßprüfungen und mit Produktprüfungen (Nr. 2.2.3) festgestellt. Die Produkte sind erst dann als hygienisch unbedenklich einzustufen, wenn alle Prüfungsanforderungen erfüllt sind. Produkte, die Prüfungen nicht bestanden haben, müssen einer erneuten keimabtötenden Behandlung unterzogen werden. 2.2.1 Direkte Prozeßprüfung Mit der direkten Prozeßprüfung wird durch Einbringen von Test- oder Indikatororganismen der Wirkungsgrad des Verfahrens aus hygienischer Sicht für den gesamten Verfahrensablauf ermittelt. Eine direkte Prozeßprüfung ist innerhalb von 12 Monaten nach Inbetriebnahme einer neu errichteten Bioabfallbehandlungsanlage (Inbetriebnahmeprüfung) durchzuführen. Dies gilt entsprechend für bereits geprüfte Anlagen bei Einsatz neuer Verfahren oder wesentlicher technischer Änderung der Verfahren oder Prozeßführung. Bei bestehenden Anlagen ist eine direkte Prozeßprüfung innerhalb von 18 Monaten nach Inkrafttreten dieser Verordnung durchzuführen, soweit für die Anlage oder das eingesetzte Verfahren keine Hygieneprüfung nach den Vorgaben für die direkte Prozeßprüfung oder nach vergleichbaren Vorgaben (z.B. Prototypprüfung nach Merkblatt M 10 der Länderarbeitsgemeinschaft Abfall - LAGA -, Baumusterprüfung nach Hygiene-Baumusterprüfsystem der Bundesgütegemeinschaft Kompost e.V. oder andere vergleichbare Vorgaben) innerhalb der letzten fünf Jahre vor Inkrafttreten dieser Verordnung durchgeführt wurde. Die direkte Prozeßprüfung erfolgt in zwei zeitlich getrennten Untersuchungsgängen, wovon bei offenen Anlagen einer in der Winterperiode stattzufinden hat. Die Untersuchungen erfolgen bei jedem Untersuchungsgang an insgesamt 60 Einzelproben, wovon 24 Proben auf die Prüfung der Seuchenhygiene und 36 Proben auf die Prüfung der Phytohygiene entfallen. Die Anzahl der Einzelproben ergibt sich dabei wie folgt: - Bei der Prüfung der Seuchenhygiene wird 1 Testorganismus in Doppelproben in drei verschiedenen Rottezonen (oberer, mittlerer und unterer Bereich) sowie an vier verschiedenen Stellen der Miete eingebracht. - Bei der Prüfung der Phytohygiene werden 3 Testorganismen in drei verschiedenen Rottezonen (oberer, mittlerer und unterer Bereich) sowie an vier verschiedenen Stellen der Miete eingebracht. Für kleine Anlagen mit einer jährlichen Kapazität von bis zu 3000 Tonnen ist ein um die Hälfte reduzierter Untersuchungsumfang (Halbierung der zu untersuchenden Einzelproben) vorgesehen. Diese Reduzierung bei den betroffenen Anlagen erfolgt dadurch, daß die Testorganismen nur an zwei verschiedenen Stellen der Miete eingebracht werden. Bei Vergärungsanlagen sollte abweichend von der Einbringung der Testorganismen in drei verschiedene Behandlungszonen eine Überprüfung an drei aufeinanderfolgenden Tagen erfolgen. Zum Umfang der Prüfungen siehe auch Tabelle 1. Die Indikatororganismen werden in charakteristische Rottebereiche oder in die für eine thermische Inaktivierung der Testorganismen repräsentative Prozeßabschnitte eingelegt, durch den praxisüblichen Rotte- und Verfahrensprozeß geschleust, und nach Entnahme auf überlebende bzw. infektionsfähige Testorganismen geprüft. Ist in Ausnahmefällen die Einbringung von Testkeimen in einem Anlagenteil aus systemtechnischen Gründen nicht möglich, so muß die Eignung des Prozesses im Hinblick auf Hygiene auf andere Art durch geeignete Sachverständige nachgewiesen werden. Eine alleinige Endproduktkontrolle ist nicht ausreichend. Bis zum erfolgreichen Abschluß der direkten Prozeßprüfung dürfen Produkte aus der biologischen Abfallbehandlung zur Verwertung ausnahmsweise abgegeben werden, wenn sie die hygienische Unbedenklichkeit durch regelmäßige Endproduktprüfungen und durch die indirekte Prozeßprüfung nachweisen können. 2.2.2 Indirekte Prozeßprüfung In biologischen Abfallbehandlungsanlagen müssen Temperaturmessungen in regelmäßigen Abständen vorgenommen werden. Diese sollten möglichst kontinuierlich erfolgen. Sie müssen mindestens einmal je Arbeitstag durchgeführt und sollten automatisch aufgezeichnet werden. Die Temperaturmessungen sollen an mindestens drei repräsentativen Zonen in den für die thermische Inaktivierung relevanten Prozeßabschnitten bzw. Anlageteilen vorgenommen werden. Die prüffähigen Aufzeichnungen des Temperaturverlaufs, der Umsetzungszeitpunkte (Kompostierung) und der Beschickungsintervalle (Anaerobbehandlung) müssen mindestens 5 Jahre aufbewahrt und Überwachungsbehörden auf Anfrage vorgelegt werden. 2.2.3 Produktprüfung Die Produktprüfungen (Endproduktkontrollen) erfolgen im Rahmen der Fremdüberwachung und sollen gewährleisten, daß das Endprodukt hygienisch unbedenklich ist. In jeder Kompostierungs- und Vergärungsanlage sind mindestens halbjährliche (Durchsatzleistung der Anlage ≤ 3000 t/Jahr) bzw. vierteljährliche (Durchsatzleistung der Anlage > 3000 t/Jahr) Produktprüfungen durchzuführen. In Abhängigkeit von der Anlagenkapazität ist eine unterschiedliche Anzahl von Proben pro Jahr zu untersuchen: - Bei Anlagen mit einer Kapazität von bis zu 3000 Tonnen pro Jahr sechs Proben, - bei Anlagen mit einer Kapazität von mehr als 3000 Tonnen bis zu 6500 Tonnen jährlich sechs Proben sowie eine zusätzliche Probe je angefangener 1000 Tonnen Durchsatz, - bei Anlagen von mehr als 6500 Tonnen Kapazität pro Jahr 12 Proben sowie eine zusätzliche Probe je angefangener 3000 Tonnen Durchsatz. Zur Anzahl der zu untersuchenden Proben siehe auch Tabelle 1. Bei diesen Proben handelt es sich um Sammelmischproben (ca. 3 kg); jede Probe setzt sich aus mindestens fünf verschiedenen Teilproben zusammen, die aus unterschiedlichen Chargen des abgabefertigen Kompostes oder Gärrückstandes gewonnen werden. Die Prüfung gilt als bestanden, wenn in keiner der entnommenen Proben Salmonellen nachweisbar sind (vgl. unter Nr. 2.3.1.2) und sie nur einen geringen Gehalt (weniger als 2 pro Liter Prüfsubstrat) von keimfähigen Samen oder austriebsfähigen Pflanzenteilen enthalten (vgl. unter Nr. 2.3.2.5). Werden in den Produkten aus der biologischen Abfallbehandlung Salmonellen nachgewiesen oder übersteigt der Gehalt an keimfähigen Samen und austriebsfähigen Pflanzenteilen den genannten Richtwert von 2 pro Liter Prüfsubstrat, so läßt dies auf eine mangelnde Betriebshygiene schließen. Der Bioabfallbehandler hat in diesen Fällen die zuständige Behörde über das Ergebnis der Untersuchung sowie über die eingeleiteten Maßnahmen zu informieren. Wenn die Wiederholungsprüfung im Endprodukt zum gleichen Ergebnis führt oder wiederholt in verschiedenen untersuchten Proben Salmonellen nachgewiesen werden, sind von der zuständigen Behörde, ggf. unter Hinzuziehung von Sachverständigen, Maßnahmen zur Behebung der Mängel anzuordnen. 2.3 Methoden 2.3.1 Direkte Prozeßprüfungen und Produktprüfungen der Seuchenhygiene 2.3.1.1 Direkte Prozeßprüfung Die direkte Prozeßprüfung erfolgt mit dem Testkeim Salmonella senftenberg W775 (H2S-negativ). Dazu wird der Testkeim in Standard-I-Bouillon bei 37 °C über 18 - 24 h inkubiert. Die so erzeugte Keimsuspension enthält eine Mikroorganismenkonzentration von ca. 107- 108 KBE/ml. Bei der Kompostierung wird pro Probe ca. 300 g frisches, homogenisiertes und zerkleinertes Bioabfallmaterial aus der zu überprüfenden Anlage mit 25 ml dieser Keimsuspension getränkt und anschließend in sterile Zwiebel- oder Kunststoffsäckchen verpackt. Die Einlage der Proben in das Kompostiergut erfolgt entweder in dieser Form oder in grob perforierten stabilen und für den jeweiligen Prozeß geeigneten Probenbehältern. Nach Durchlaufen des Kompostierungsprozesses werden die Probenbehälter wieder entnommen und jeweils 50 g des homogenisierten Inhalts eines Probensäckchens werden in 450 ml gepuffertem Peptonwasser über 30 Minuten bei 4 °C langsam ausgeschüttelt und anschließend über 20 Stunden bei 37 °C inkubiert. Die so erhaltene Suspensionslösung wird für die Identifizierung von Salmonellen benutzt. In Vergärungsanlagen werden in Abhängigkeit von der Verfahrensweise jeweils 1,5 ml der Keimsuspension von Salmonella senftenberg W775 (H2S-negativ) entweder mit Hilfe von Plastikampullen (2 ml Inhalt) oder auf 'Diffusionskeimträgern' nach RAPP (1995; mod. nach FINK, 1997) in den Prozeß eingeschleust. Das Einbringen der Diffusionskeimträger, die außer mit 2 ml der Keimsuspension und 15 ml Gärrückstand angefüllt sind, erfolgt in den für die thermische Inaktivierung relevanten Prozeßabschnitten bzw. Anlageteilen. Nach Durchlaufen des Verfahrens werden jeweils 1 ml Probe in 9 ml gepuffertem Peptonwasser (Voranreicherung) kurz geschüttelt und über 20 Stunden bei 37 °C inkubiert. Die so erhaltene Suspension wird für die Identifizierung von Salmonellen benutzt. Die Identifizierung von Salmonellen erfolgt mit den nach der oben beschriebenen Methode hergestellten Suspensionslösungen. Hierzu werden jeweils 0,1 ml aus der gut durchmischten Voranreicherung in 10 ml Anreicherungsbouillon nach Rappaport bei 37 °C und bei 43 °C über 24 Stunden inkubiert. Anschließend werden Parallelausstriche auf Brillantgrün-Phenolrot-Saccharose-Agar (BPLSA) und Xylose-Lysin-Desoxycholat-Agar (XLD) angelegt und bei 37 °C über 24 Stunden bebrütet. Salmonellenverdächtige Kolonien werden durch biochemische und serologische Verfahren identifiziert. Bei der Durchführung im Labor sind Kontrollproben mitzuführen. Zur Kontrolle der Überlebensfähigkeit (Tenazität) des Teststammes werden parallel zur Prozeßprüfung vier Kontrollproben hergestellt. Diese Kontrollproben werden nicht in den Rottekörper eingebracht, sondern in feuchtem Sand (z.B. Eimer mit Quarzsand, Befeuchtung mit deionisiertem Wasser) bei Raumtemperatur (20 - 25 °C) gelagert und nach Abbruch der Prozeßprüfung aufgearbeitet. Die Kontrollproben sollten bei mindestens drei der vier Proben positive Salmonellenbefunde liefern; anderenfalls ist die Tenazität des Teststammes nicht als ausreichend anzusehen. Die Prozeßprüfung gilt als bestanden, wenn in dem für die thermische Inaktivierung relevanten Verfahrensschritt, oder nachdem die eingelegten Proben die Verfahrensschritte durchlaufen haben, in keiner Probe Salmonellen nachweisbar sind. 2.3.1.2 Produktprüfung Für die Produktprüfung werden aus einer gut durchmischten Sammelprobe (ca. 3 kg) aus fünf Teilproben des abgabefertigen Kompostes bzw. Gärrückstandes jeweils 50 g Material nach der oben angegebenen Methode (s. Nr. 2.3.1.1) auf das Vorhandensein von Salmonellen untersucht. Bei Vergärungsanlagen, die ein flüssiges Produkt abgeben, sind die Proben entweder direkt am Ablauf des Reaktors oder im Zwischenspeicher zu ziehen. Die Produktprüfung gilt als bestanden, wenn in jeweils 50 g der entnommenen Sammelproben Salmonellen nicht nachweisbar sind. 2.3.2 Direkte Prozeßprüfungen und Produktprüfung in der Phytohygiene Die zur Feststellung der phytohygienischen Unbedenklichkeit bei anaerober Behandlung erforderlichen Prüfungen sind analog dem Prüfsystem bei der Kompostierung durchzuführen. 2.3.2.1 Testorganismen und Richtwerte Aus der Vielzahl von Phytopathogenen und Pflanzensamen, die im Ausgangsmaterial von biologischen Abfallbehandlungsanlagen vorkommen, werden folgende Leit- oder Indikatororganismen in direkten Prozeßprüfungen verwendet: - Tabak-Mosaik-Virus (TMV), Richtwert im Biotest: ≤ 8 Läsionen/Pflanze, - Plasmodiophora brassicae (Kohlhernie), Richtwert im Biotest: Befallsindex ≤ 0,5, - Tomatensamen, Richtwert im Biotest: ≤ 2 % keimfähige Samen/Probe. Wenn die angegebenen Richtwerte in Proben, die entweder den Gesamtprozeß oder den für die thermische Inaktivierung relevanten Verfahrensschritt durchlaufen haben, bei den Parametern Tabak-Mosaik-Virus oder Tomatensamen um mehr als maximal 30 % überschritten werden, gelten direkte Prozeßprüfungen als nicht bestanden. Bei dem Parameter Plasmodiophora brassicae ist eine Überschreitung des Richtwertes nicht zulässig. 2.3.2.2 Prüfmethodik Tabak-Mosaik-Virus Die Prüfung erfolgt in Anlehnung an die von BRUNS et al. (1994) weiterentwickelte Methodik nach KNOLL et al. (1980). 2.3.2.2.1 Herstellung der Einlegeproben Jede in den biologischen Behandlungsprozeß eingeschleuste Probe enthält eine Menge von 10 g mit TMV infizierten Tabakblättern (Nicotiana tabacum Samsun) und 100 g des jeweiligen Kompostrohmaterials. Beide Komponenten werden miteinander vermischt und in 15 x 15 cm große Säckchen aus rottebeständiger Gaze (Maschenweite 1 x 1 mm) gefüllt, wobei sicherzustellen ist, daß kein Austrag von Prüforganismen in den umgebenden Kompost erfolgt. In Vergärungsanlagen werden 10 g von TMV infizierten zerkleinerten Tabakblättern in mit Substrat durchmischten Diffusionskeimträgern verwendet, die in rottebeständigen stabilen Probebehältern in den Prozeß eingelegt werden. Die Vermehrung des Virus erfolgt in Tabakpflanzen (Nicotiana tabacum var. Samsun), in denen es sich systemisch ausbreitet. Dazu werden die Tabakpflanzen unter normalen Gewächshausbedingungen bis zum 5-Blattstadium herangezogen. Zur Inokulation werden 2 oder 3 untere Blätter mit Karborund, Celite oder Bentonit dünn eingepudert und die TMV-haltige Suspension (Pflanzenpreßsaft aus mit TMV infizierten Tabakpflanzen) in 0,05 mol/l Phosphatpuffer (pH-Wert 7) mit einem Pinsel, Glasspatel oder Gazebausch vorsichtig auf die bestäubten Blätter aufgetragen. 2 - 3 Wochen nach Inokulation können dann virushaltige Blätter mit mosaikartigen Verfärbungen für die Untersuchungen verwendet werden. Die Kontrollen werden bei ca. -18 °C in der Gefriertruhe aufbewahrt. 2.3.2.2.2 Nachweis der Infektiosität von TMV Sofort nach der Entnahme der Probenträger aus der Kompostierungs- oder Vergärungsanlage wird der Inhalt entnommen und die eventuell vorhandenen nicht verrotteten groben Bestandteile (Holz, Steine, usw.) herausgesucht. In einem Mixer erfolgt unter Zusatz von 30 ml Phosphatpuffer (0,05 mol/l; pH 7) die Zerkleinerung der Probe. Das Probenhomogenat sollte eine breiige Konsistenz haben, also nicht flüssig sein. Der Brei wird in den Gazebeutel zurückgegeben und überschüssige Flüssigkeit ausgepreßt (Extrakt). Mit den Kontrollproben wird in gleicher Weise verfahren. Als Nachweis für die Infektion werden die Extrakte aus den Proben und aus den Kontrollen auf Blätter der Testpflanze Nicotiana glutinosa aufgetragen. Als Nachweistechnik wird die Halbblattmethode angewandt (WALKEY, 1991). Die Pflanzen sollten sich im 6-8 Blattstadium befinden. Die Vegetationsspitze und die unteren Blätter werden entfernt, so daß sich 4 voll ausgebildete Blätter an den Pflanzen befinden. Das 2. und 3. Blatt hiervon werden mit den virushaltigen Extrakten inokuliert, indem jeweils eine Blatthälfte mit dem Kontrollextrakt, die andere mit dem Probenextrakt abgerieben wird. Die genannte Tabaksorte reagiert auf TMV mit sogenannten Lokalläsionen: Es entstehen kleine, runde Flecken, deren Zentren aus abgestorbenem, nekrotischem Gewebe bestehen. 10 Tage nach der Inokulation werden die entstandenen Lokalläsionen ausgezählt. Die Auswertung erfolgt durch Addition der Läsionen der beiden Blatthälften jeder Pflanze, die mit der Probenlösung infiziert werden. 2.3.2.3 Prüfmethodik Plasmodiophora brassicae Die Prüfung erfolgt in Anlehnung an die von BRUNS et al. (1994) weiterentwickelte Methodik nach KNOLL et al. (1980). 2.3.2.3.1 Herstellung von Einlegeproben Jede in den Prozeß eingeschleuste Probe enthält eine Menge von 30 g Gallenmaterial mit P. brassicae von befallenen Kohlpflanzen, 430 g infektiösen Boden und 200 g des jeweiligen Kompostrohmaterials. In Vergärungsanlagen werden 10 g zerkleinertes Gallenmaterial mit Substrat vermischt über Diffusionskeimträger in den Prozeß eingeschleust. Dies entspricht einem Verhältnis von ca. 5 % Gallenmaterial zu 65 % Boden und 30 % Kompost. Bis zum Versuchsansatz werden die Gallen bei -25 °C tiefgefroren. Die einzelnen Probenanteile werden intensiv gemischt und in rottefeste Beutel (Maschenweite max. 1 mm) eingefüllt. Dabei ist sicherzustellen, daß kein Austrag von Prüforganismen in den umgebenden Kompost erfolgt. Als Kontrollen dienen ein Gemisch mit Gallen, infiziertem Boden und sterilem Sand anstelle des Kompostrohmaterials in den o.g. Mischungsverhältnissen. Die Kontrollen werden während des Versuchszeitraums in feuchtem, sterilisiertem Sand bei Zimmertemperatur gelagert. 2.3.2.3.2 Nachweis der Infektiosität mittels Biotest Nach Rückgewinnung aus dem Verfahren werden alle Erregerproben von groben Holzstücken befreit, sorgfältig zerkleinert und ein Anteil von 325 ml Probe mit 275 ml eines Sand-Torf-Gemisches (30 %:70 % = V:V; Sand 5 Stunden bei 80 °C gedämpft) vermischt. Dies ergibt eine gesamte Substanzmenge von ca. 600 ml je Probe mit einem pH-Wert von > 6 (CaCl2). Zur Kontrolle des pH-Wertes, der einen starken Einfluß auf die Infektiosität von P. brassicae ausübt, wird eine Blindprobe hinzugezogen, die kein Gallenmaterial enthält, aber während des gesamten Versuchszeitraumes im geprüften Kompost oder Gärrückstand gelagert hat. Mit dieser Probe wird zunächst die Mischung vorbereitet, dann der pH-Wert bestimmt und falls der Wert von 6 (CaCl2) über- oder unterschritten wird, entsprechend korrigiert (Erhöhung/Reduzierung des Torfanteils). Für jede Probe wird im Biotest ein Gefäß mit Nachweispflanzen angelegt. Als Nachweispflanzen dienen 14 Tage alte Sarepta-Senfpflanzen (Brassica juncea) der Sorte Vittasso. In jedes Gefäß und entsprechend pro Erregerprobe werden jeweils 4 Pflanzen pikiert. Die Düngung der Versuchspflanzen in der Kontrolle erfolgt mit 250 mg N, 100 mg P2O5, 300 mg K2O und 100 mg Mg pro Liter Kultursubstrat. Bedingt durch die i.d.R. sehr hohen P- und K-Gehalte in den Komposten kann eine Zusatzdüngung dieser Nährstoffe in den Gefäßen mit den Proben meist unterbleiben. Der Biotest wird als randominisierte Blockanlage in Lichtthermostaten bei 8000 Lux und einer Temperatur von 16 - 18 °C in der ersten bzw. 22 °C ab der zweiten Woche gefahren. Die Wuchszeit des Biotests beträgt 5 Wochen. Nach Ende des Biotests wird zum einen die Anzahl der befallenen Pflanzen gezählt und zum anderen die Wurzelgallenbildung nach einer Boniturskala von 0 - 3 nach BUCZACKI et al. (1975) bewertet. Klasse 0 - keine mittlere Schwellung an den Seiten- wie an den Hauptwurzeln und Klasse 3 - starke Schwellung an Lateral- wie an den Hauptwurzeln. Die Boniturnoten werden nach folgender Formel im Befallsindex zusammengefaßt: Befallsindex = ( Summe(Anzahl befallener Pflanzen u Befallsklasse) ) / Gesamtzahl Pflanzen 2.3.2.4 Prüfmethodik Tomatensamen Die Prüfung erfolgt in Anlehnung an die bei POLLMANN und STEINER (1994) angegebene Methodik. 2.3.2.4.1 Herstellung der Einlegeprobe Etwa 1 g oder 400 Tomatensamen, Lycopersicon lycopersicum (L.) Karsten ex Farw., der Sorte St. Pierre, in einen kleinen Beutel aus unverrottbarem Gazestoff (Maschenweite 0,1 cm x 0,1 cm) füllen und vor dem Verschließen auf der gesamten Gazefläche verteilen, um eine möglichst geringe Schichtdecke der Tomatensamen zu erreichen. Den verschlossenen Beutel in einen Probensack, der mit mindestens 5 l frischem Bioabfall der zu untersuchenden Partie gefüllt ist, einlegen. In Vergärungsanlagen wird eine entsprechende Menge Tomatensamen in einem Diffusionskeimträger eingebracht. Die Keimfähigkeit der Tomatensamen muß vor der Durchführung der Untersuchungen bestimmt werden. Zur Prüfung darf nur Saatgut mit einer Mindestkeimfähigkeit von 90 % herangezogen werden. 2.3.2.4.2 Bestimmung der Keimrate der Tomatensamen nach Entnahme der Einlegeproben Die entnommene Einlegeprobe während des Transports zwischen Entnahme und Aufarbeitung sowie während einer möglichen Zwischenlagerung in einem luftdichten Behälter kühl halten (Kühlbox, Kühlschrank). Mit der Keimfähigkeitsprüfung umgehend nach der Entnahme der Proben aus dem Kompost beginnen. Die Tomatensamen aus dem Beutel entnehmen und 200 Samen abzählen. Die restlichen Samen während 1 bis 2 Tagen unter Wohnraumbedingungen (20 - 50 % rel. Luftfeuchte, etwa 20 °C) zurücktrocknen, luftdicht verschließen und für etwaige Wiederholungen der Keimfähigkeitsbestimmung im Kühlschrank aufbewahren (Rückhalteprobe). Die abgezählten Samen in sauberem Zustand, falls erforderlich abgewaschen, zur Keimfähigkeitsbestimmung auslegen, z.B. 4 x 50 Samen in abgedeckten Petrischalen mit 9 cm Durchmesser auf 4 Lagen angefeuchtetem Filterpapier bei 25 °C und Belichtung in einem geeigneten Raum oder Klimaschrank (ANONYM, 1993). Die Anzahl der gekeimten Tomatensamen im siebentägigen Rhythmus auszählen. Die Zählung alle 7 Tage wird solange wiederholt, bis keine weiteren Samen gekeimt sind. Als gekeimt gilt der Samen, bei dem die Wurzel und/oder der Sproß sichtbar ausgetreten ist. Sind nach 21 Tagen keine Samen gekeimt, wird die Keimfähigkeitsprüfung abgeschlossen. Die Gesamtzahl gekeimter Samen feststellen und als Prozentsatz der verwendeten Samen in der geprüften Aliquote (200 Samen) angeben. 2.3.2.5 Produktprüfungen in der Phytohygiene Bei der Produktprüfung im Bereich der Phytohygiene wird der Gehalt an keimfähigen Samen und austriebsfähigen Pflanzenteilen im zu verwertenden Produkt aus biologischen Abfallbehandlungsanlagen mit der Kultivierungsmethode bestimmt. Hierzu werden ca. 3 kg des abgabefertigen Kompostproduktes auf < 10 mm gesiebt und über 3 Tage einer Temperatur von 4 °C ausgesetzt. Nach Bestimmung des Salzgehaltes (Bundesgütegemeinschaft Kompost 1994, Methode 8) wird das auf diese Art hergestellte Prüfsubstrat mit einer geeigneten Mischkomponente (KCl-Gehalt = 0 g/l) so verdünnt, daß die Prüfmischung einen Salzgehalt von < 2 g KCl pro Liter aufweist. Als Mischkomponente, die frei von keimfähigen Samen und austriebsfähigen Pflanzenteilen sein muß, eignet sich Hochmoortorf mit ca. 4 g kohlensaurem Kalk pro Liter. Die Prüfmischung wird in einer Schichtdicke von ca. 10 mm in Versuchsschalen (Kunststoffschalen mit Bodenlochung oder gleichwertige Behältnisse, die mit einer Gießmatte und einer Nadellochfolie als Verschmutzungsschutz ausgelegt sind) gleichmäßig ausgebracht, leicht angedrückt und durch Gießen auf volle Wasserkapazität gebracht. Danach werden die Versuchsbehältnisse über einen Zeitraum von 15 Tagen bei einer Beleuchtungsstärke von mindestens 1000 Lux und einer Temperatur von 18 - 20 °C ohne direkte Sonneneinstrahlung belassen. Der Wasserverlust wird regelmäßig durch Überbrausen ausgeglichen. Um eine Austrocknung zu vermeiden, können die Schalen mit Glas- oder Kunststoffscheiben so abgedeckt werden, daß ein Luftaustausch weiterhin möglich ist. Die Produktprüfung gilt als bestanden, wenn der Gehalt an keimfähigen Samen und austriebsfähigen Pflanzenteilen nach dieser Zeit kleiner als 2 pro Liter Prüfsubstrat ist. 3 Literatur ANONYM, Internationale Vorschriften für die Prüfung von Saatgut. Seed Science and Technology 21, Supplement, Vorschriften, 1993 BRUNS, C., GOTTSCHALL, R., MARCHINISZYN, E., SCHÜLER, C., ZELLER, W., WOLF, G. und VOGTMANN, H., Phytohygiene der Kompostierung - Sachstand, Prüfmethoden, F.- und E.-Vorhaben, Tagungsband 'BMFT-Statusseminar Neue Techniken der Kompostierung', Hamburg, S. 191-206, 1994 BUCZACKI, S. T., TOXOPEUS, H., MATTUSCH, P., JOHNSTON, T. D., DIXON, G. R. and HOBOLTH, L. A., Study of physiologic specializiation in plasmodiophora brassicae; proposals for rationalization through an international approach, Transactions for the British Mycological Society, 65, pp. 295-303, 1975 BUNDESGÜTEGEMEINSCHAFT KOMPOST E.V., Methodenhandbuch zur Analyse von Kompost Nr. 222, Methode 8, Köln, 1994 BUNDESGÜTEGEMEINSCHAFT KOMPOST E.V., Hygiene-Baumusterprüfsystem für Kompostierungsanlagen, Kompost-Information Nr. 225, Köln, 1996 BÖHM, R., FINK, A., MARTENS, W., PHILIPP, W., WEBER, A. und WINTER, D., Abschlußbericht zum Forschungsvorhaben 02-WA 9257/5 'Veterinär- und seuchenhygienische Untersuchungen zur Überprüfung von Gülleaufbereitungsverfahren und der erzeugten Gülleaufbereitungsprodukte'. Institut für Umwelt- und Tierhygiene der Universität Hohenheim, 1997 HERMANN, I., MEISSNER, S., BÄCHLE, E., RUPP, E., MENKE, G. und GROSSMANN, F., Einfluß des Rotteprozesses von Bioabfall auf das Überleben von phytopathogenen Organismen und Tomatensamen, Zeitschrift für Pflanzenkrankheiten und Pflanzenschutz, 101 (1), S. 48-65, 1994 KNOLL, K.-H., STRAUCH, D. und HOLST, H., Standardisierung von Hygieneuntersuchungen für Kompostierungsverfahren. Forschungsbericht 79-10302403, Umweltforschungsplan des BMI, Abfallwirtschaft, 1980 LÄNDERARBEITSGEMEINSCHAFT ABFALL (LAGA), LAGA-Merkblatt M 10: Qualitätskriterien und Anwendungsempfehlungen für Kompost, Stand 15. 2. 1995 POLLMANN, B. und STEINER, A. M., A standardized method for testing the decay of plant diaspores in biowaste composts by using tomato seed, Agribiological Research, 47, 1, 24-31, 1994 RAPP, A., Hygienisch-mikrobiologische Untersuchungen zum Verhalten von ausgewählten Bakterien und Viren während der längerfristigen Speicherung von Flüssigmist in Güllegemeinschaftsanlagen. Agrarwissenschaftliche Dissertation, Universität Hohenheim, 1995 WALKEY, D. G. A., Applies plant virology, Second edition, Chapman and Hall, London, 1991 Tabelle 1: Prüfungsumfang des Nachweises der seuchen- und phytohygienischen Unbedenklichkeit bei Kompostierungs- und Vergärungsanlagen Qualitätsparameter | direkte Prozeßprüfung | indirekte Prozeßprüfung | Produktprüfung Seuchen- und phyto- hygienische Unbe- denklichkeit | Kontrolle des Wirkungsgrades des Verfahrens | Fortlaufende Temperatur- kontrolle | Endproduktkontrolle 3), 4) Seuchen- und Phyto- hygiene | - Neu errichtete Kompostierungs- und Vergärungsanlagen (inner- halb von 12 Monaten nach Inbe- triebnahme), - bereits geprüfte Anlagen bei Ein- satz neuer Verfahren oder wesentlicher Änderung der Ver- fahren/Prozeßführung (innerhalb von 12 Monaten nach Einsatz/Änderung), - bestehende Anlagen ohne Hygie- neprüfung der Anlage oder des Verfahrens innerhalb der letzten fünf Jahre vor Inkrafttreten dieser Verordnung (innerhalb von 18 Monaten nach Inkrafttreten dieser Verordnung). | - Kontinuierliche Tempe- raturmessung an drei repräsentativen Stellen im Hygienisierungsbe- reich (-teil), - prüffähige Aufzeichnung von Daten (u. a. Umsetz- termine, Feuchtigkeits- gehalt, Befüllung/Entlee- rung) | Regelmäßige Prüfung des abgabeferti- gen Kompostes und Gärrückstandes auf hygienische Unbedenklichkeit. Anzahl der Untersu- chungsgänge | 2 Untersuchungsgänge; bei offenen Anlagen einer im Winter | Permanente, nachprüfbare Aufzeichnung (5 Jahre Aufbewahrung) | Kontinuierlich über ein Jahr verteilt, mindestens jedoch - halbjährlich (Anlagen-Durchsatzlei- stung ≤ 3000 t/a), - vierteljährlich (Anlagen-Durchsatzlei- stung > 3000 t/a) Anzahl der Prüforga- nismen | Seuchen- hygiene | 1 Testorganismus (Salmonella senftenberg W775, H2S-neg.) | - | Salmonellen (In 50 g Kompost oder Gärrückstand nicht nachweisbar) Phyto- hygiene | 3 Testorganismen (Plasmodiophora brassicae, Tabak- Mosaik-Virus, Tomatensamen) | - | Keimfähige Samen und austriebsfähige Pflanzenteile; weniger als 2 pro Liter Prüfsubstrat Probenzahl (je Test- durchgang): | | - | Anlagendurchsatz in Jahrestonnen: 1. ≤ 3000 (6 Proben/Jahr), 2. > 3000 - 6500 (6 Proben/Jahr + je angefangener 1000 t eine weitere Probe), 3. > 6500 (12 Proben/Jahr + je ange- fangener 3000 t eine weitere Probe) Seuchenhygiene Phytohygiene | 24 1), 2) 36 1), 2) Summe, gesamt | 60 | | 1) Halbe Probenzahl bei kleinen Anlagen (Mengendurchsatz < 3.000 t/a) 2) Die direkte Prozeßprüfung in Vergärungsanlagen kann auch in mehreren Durchgängen hintereinander erfolgen. So kann z.B. der für die thermische Inaktivierung relevante Anlagenteil in drei Chargen an drei aufeinanderfolgenden Tagen untersucht werden. 3) Die Aussagen zur seuchenhygienischen Unbedenklichkeit von behandelten Materialien gelten nur, wenn sowohl die Endproduktprüfungen als auch die Prozeßprüfungen bestanden wurden. 4) Die Proben sind Sammelmischproben (ca. 3 kg) aus je fünf Teilproben des abgabefertigen Produktes. | Die behandelten Bioabfälle sind erst dann als hygienisch unbedenklich einzustufen, wenn alle Prüfungen gemäß den Nummern 3.1 bis 3.3 bestanden sind. 3.1 Prozessprüfung (zu § 3 Absatz 4 Satz 1 Nummer 1 i. V. m. Absatz 5) 3.1.1 Allgemeine Anforderungen Die Prozessprüfung ist eine Untersuchung der einzelnen Behandlungsanlage zur Hygienisierung, die jeweils einmalig bei Neuerrichtung der Anlage und bei wesentlicher Änderung des Verfahrens durchzuführen ist. Hiermit wird die Wirksamkeit des Hygienisierungsverfahrens ermittelt. Dazu werden mit dem Bioabfall seuchen- und phytohygienisch relevante Test- oder Indikatororganismen in die Anlage eingebracht; anhand von Untersuchungen der behandelten Materialien wird dann überprüft, ob durch die Hygienisierung die Testorganismen abgetötet oder inaktiviert worden sind. Für eine anderweitige hygienisierende Behandlung (Nummer 2.2.4) sind die Anforderungen an die Prozessprüfung in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, so zu bestimmen und zu beschreiben, dass ein gleichwertiges Hygienisierungsniveau unter Berücksichtigung der Vorgaben dieses Abschnitts sowie der Methoden gemäß Nummer 4.2.1 (Seuchenhygiene) und Nummer 4.3.1 (Phytohygiene) erreicht wird. Für die Prozessprüfung sind die Methoden (Probenahme, -vorbereitung, Untersuchungen und einzuhaltende höchstzulässige Grenzwerte) in der Seuchenhygiene gemäß Nummer 4.2.1 und in der Phytohygiene gemäß Nummer 4.3.1 und nach Maßgabe der nachfolgend für die jeweilige Anlage näheren Beschreibungen (s. Nummer 3.1.2 und 3.1.3) anzuwenden (§ 3 Absatz 4 Satz 2). Die Prozessprüfung ist erfolgreich abgeschlossen, wenn die Grenzwerte gemäß Nummer 4.2.1.1 (Seuchenhygiene) und Nummer 4.3.1.1 (Phytohygiene) in den zwei aufeinanderfolgenden Untersuchungsgängen jeweils nach dem für die Hygienisierung relevanten Verfahrensschritt nicht überschritten werden. 3.1.2 Anlagen zur aeroben hygienisierenden Behandlung (thermophile Kompostierungsanlagen) Die Prozessprüfung umfasst zwei zeitlich getrennte Untersuchungsgänge in einem Mindestabstand von 3 Monaten, wovon einer im Winter stattzufinden hat. Die Testorganismen werden in charakteristische Rottebereiche oder in die für die thermische Inaktivierung der Testorganismen repräsentativen Prozessabschnitte eingebracht und nach der Entnahme auf überlebende oder infektiöse Testorganismen geprüft. 3.1.2.1 Mietenkompostierung Bei jedem Untersuchungsgang werden insgesamt 60 Einzelproben untersucht, wovon 24 Proben auf die Prüfung der Seuchenhygiene und 36 Proben auf die Prüfung der Phytohygiene entfallen. Die Anzahl der Einzelproben ergibt sich dabei wie folgt: a) Bei der Prüfung der Seuchenhygiene wird 1 Testorganismus (s. Nummer 4.2.1) in Doppelproben in drei verschiedene Rottezonen (Rand-, Kern- und Basis-Bereich) sowie an vier verschiedenen Stellen der Miete eingebracht. b) Bei der Prüfung der Phytohygiene werden 3 Testorganismen (s. Nummer 4.3.1) als Einzelproben in drei verschiedene Rottezonen (Rand-, Kern- und Basis-Bereich) sowie an vier verschiedenen Stellen der Miete eingebracht. Die Proben am Rand dürfen mit ca. 10 cm Rottegut überdeckt werden. Die Proben bleiben bis zum Ende der Prüfung in den jeweiligen Bereichen. Für kleine Anlagen mit einer jährlichen Kapazität von bis zu 3.000 Tonnen Einsatzmaterialien ist nur ein reduzierter Untersuchungsumfang mit einer Halbierung der zu untersuchenden Einzelproben erforderlich. Dabei werden die Testorganismen nur an zwei verschiedenen Stellen der Miete eingebracht. 3.1.2.2 Andere Kompostierungsverfahren Bei jedem Untersuchungsgang werden insgesamt 60 Einzelproben untersucht, wovon 24 Proben auf die Prüfung der Seuchenhygiene (1 Testorganismus, s. Nummer 4.2.1) und 36 Proben auf die Prüfung der Phytohygiene (3 Testorganismen, s. Nummer 4.3.1) entfallen. Die Testorganismen werden in charakteristische Bereiche des Rottekörpers eingelegt oder bei dynamischen Verfahren in geeigneten Probebehältern mit dem Materialstrom durch den praxisüblichen Rotte- und Verfahrensprozess geschleust. Die eingesetzten Probenbehälter müssen eine ausreichende Perforation aufweisen, so dass die Stoffumsetzungsbedingungen innerhalb der Probenbehälter denen des zu prüfenden Kompostierungsprozesses zur Hygienisierung entsprechen. Bei dynamischen Verfahren ist darauf zu achten, dass alle Prüforganismen während des gesamten Einbringvorgangs zeitlich möglichst gleichmäßig zugegeben werden, so dass sie sich möglichst homogen im Rotteaggregat verteilen. Zusätzlich muss die Form der verwendeten Probenbehälter sicherstellen, dass sie bezüglich des Verhaltens im Materialstrom und der Verweilzeit dem zu kompostierenden Material entsprechen. Sofern die spezifische Anlagentechnik die Größe der Probenbehälter nicht begrenzt (z. B. freie Durchgänge bei Schnecken usw.), werden insgesamt 12 Probenbehälter in das Rotteaggregat eingebracht (durchgeschleust); jeder Probenbehälter enthält a) einen Testorganismus in Doppelproben zur Prüfung der Seuchenhygiene (s. Nummer 4.2.1) und b) drei Testorganismen als Einzelproben zur Prüfung der Phytohygiene (s. Nummer 4.3.1). Ist die Einbringung (Durchschleusung) entsprechend großer Probenbehälter nicht möglich, müssen die Einzelproben auf eine entsprechend größere Anzahl kleinerer Probenbehälter verteilt werden. Für kleine Anlagen mit einer jährlichen Kapazität von bis zu 3.000 Tonnen Einsatzmaterialien ist nur ein reduzierter Untersuchungsumfang mit einer Halbierung der zu untersuchenden Einzelproben erforderlich. Dabei werden statt der 12 nur 6 Probenbehälter eingebracht und durchgeschleust. 3.1.3 Anlagen zur anaeroben hygienisierenden Behandlung (thermophile Vergärungsanlagen) Die Prozessprüfung umfasst zwei zeitlich getrennte Untersuchungsgänge in einem Mindestabstand von 3 Monaten. Bei jedem Untersuchungsgang werden insgesamt 24 Einzelproben untersucht, wovon 8 Proben auf die Prüfung der Seuchenhygiene und 16 Proben auf die Prüfung der Phytohygiene entfallen. Die Anzahl der Einzelproben ergibt sich dabei wie folgt: a) Bei der Prüfung der Seuchenhygiene wird 1 Testorganismus (s. Nummer 4.2.1) in Doppelproben sowie an vier verschiedenen Stellen im Fermenter (bei stehenden Fermentern in vertikaler und bei liegenden Fermentern in horizontaler Richtung) eingebracht. b) Bei der Prüfung der Phytohygiene werden 2 Testorganismen (s. Nummer 4.3.1 mit Ausnahme des Tabakmosaikvirus) in Doppelproben sowie an vier verschiedenen Stellen im Fermenter (bei stehenden Fermentern in vertikaler und bei liegenden Fermentern in horizontaler Richtung) eingebracht. Für kleine Anlagen mit einer jährlichen Kapazität von bis zu 3.000 Tonnen Einsatzmaterialien ist nur ein reduzierter Untersuchungsumfang mit einer Halbierung der zu untersuchenden Einzelproben erforderlich. Dabei werden die Testorganismen nur an zwei verschiedenen Stellen im Fermenter eingebracht. Die Testorganismen werden für die technisch vorgegebene oder nachgewiesene Mindestverweilzeit (s. Nummer 2.2.3.2) in den Fermenter eingebracht und nach Entnahme untersucht. Für die Durchführung der Prozessprüfung müssen für die Einlage und Entnahme von Proben geeignete Öffnungen in den Gärbehältern vorhanden sein. 3.2 Prozessüberwachung (zu § 3 Absatz 4 Satz 1 Nummer 2 i. V. m. Absatz 6) Die Prozessüberwachung ist eine kontinuierliche Prüfung und Aufzeichnung der Temperatur während der Behandlung zur Hygienisierung. Hiermit wird nachgewiesen, ob während der Behandlung die für die Hygienisierung erforderliche Temperatur und die notwendige Einwirkungsdauer eingehalten wird. Für eine anderweitige hygienisierende Behandlung (Nummer 2.2.4) sind die Anforderungen an die Prozessüberwachung in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, so zu bestimmen und zu beschreiben, dass ein gleichwertiges Hygienisierungsniveau unter Berücksichtigung der Vorgaben dieses Abschnitts erreicht wird. Wird in einer geschlossenen Kompostierungsanlage zur Hygienisierung die Temperatur im Abluftstrom der Kompostmiete gemessen und aufgezeichnet (§ 3 Absatz 6 Satz 3), ist die Behandlungstemperatur über einen anlagenspezifischen Korrekturfaktor gegenüber der direkten Temperaturmessung im Rottegut zu ermitteln. Der anlagenspezifische Korrekturfaktor ist regelmäßig durch parallele direkte Temperaturmessungen im Rottegut zu überprüfen. Für die Temperaturmessung im Abluftstrom sind die Anforderungen in Abstimmung mit der zuständigen Behörde, ggf. unter Hinzuziehung eines Sachverständigen, festzulegen. Die Temperaturmessungen sind in repräsentativen Zonen der für die Hygienisierung relevanten Prozessabschnitte oder Anlageteile vorzunehmen. Die Prozessüberwachung ist erfolgreich durchlaufen, wenn die für das jeweilige Verfahren vorgegebene Temperatur und Einwirkungsdauer (vgl. Nummer 2.2.1.1, 2.2.2.1, 2.2.3.1 und 2.2.4.1) bei der hygienisierenden Behandlung des Materials eingehalten wurden. 3.3 Prüfungen der hygienisierten Bioabfälle (zu § 3 Absatz 4 Satz 1 Nummer 3 i. V. m. Absatz 7 und 7a) Die Prüfungen der hygienisierten Bioabfälle sind regelmäßige Untersuchungen der Materialien nach der Behandlung zur Hygienisierung auf Krankheitserreger, keimfähige Samen und austriebsfähige Pflanzenteile. Die Prüfungen der hygienisierten Bioabfälle erfolgen nach der Hygienisierungsbehandlung (s. Nummer 2) am abgabefertigen Material. Bei jeder Prüfung der hygienisierten Bioabfälle ist jeweils eine Probe in der Seuchenhygiene und in der Phytohygiene zu untersuchen. Für die Prüfungen sind die Methoden (Probenahme, -vorbereitung, Untersuchungen und einzuhaltende höchstzulässige Grenzwerte) in der Seuchenhygiene gemäß Nummer 4.2.2 und in der Phytohygiene gemäß Nummer 4.3.2 anzuwenden (§ 3 Absatz 4 Satz 2). Die Prüfungen der hygienisierten Bioabfälle sind erfolgreich abgeschlossen, wenn die Grenzwerte gemäß Nummer 4.2.2 letzter Absatz (Seuchenhygiene) und Nummer 4.3.2 letzter Absatz (Phytohygiene) in keiner der entnommenen Proben überschritten werden. 4 Methoden zur Prüfung der seuchen- und phytohygienischen Unbedenklichkeit 4.1 Traceruntersuchungen zur Ermittlung der Mindestverweilzeit bei anaeroben hygienisierenden Behandlungsverfahren (thermophile Vergärung) Um die hygienisierende Wirkungsweise von anaeroben Behandlungsverfahren beurteilen zu können, ist die Kenntnis der Mindestverweilzeit der Abfallsuspension im Fermenter von Bedeutung. Muss die Mindestverweilzeit ermittelt werden, ist hierfür eine Traceruntersuchung durchzuführen (s. Nummer 2.2.3.2). Bei der Traceruntersuchung wird die Abfallsuspension vor dem Eintritt in den Fermenter mit Indikatoren (Tracern) markiert und deren erstmaliges Auftreten am Auslauf erfasst. Für die Traceruntersuchung in anaeroben Behandlungsanlagen zur Hygienisierung biologisch abbaubarer Abfälle sind biologische Tracer mit den Sporen von Bacillus globigii (s. Nummer 4.1.1) oder chemische Tracer mit Lithium (s. Nummer 4.1.2) geeignet. 4.1.1 Traceruntersuchung mit Sporen von Bacillus globigii Als biologischer Tracer werden die Sporen von Bacillus globigii verwendet. Sporen dieses Testbakteriums kommen natürlicherweise nicht in den biologischen Substraten vor, sie sind apathogen für Mensch und Tier, überstehen die Prozesseinwirkungen in anaeroben Behandlungsanlagen und sind problemlos nachweisbar. 4.1.1.1 Vorbereitung Benötigte Materialien und Reagenzien - Trypton-Glucose-Bouillon (TGB), zur Herstellung der Impfkultur von Bacillus globigii-Sporen: Hefeextrakt: 2,5 g, Trypton: 5,0 g, Glucose: 1,0 g, Wasser (destilliert): 1.000 ml; - Hefeextrakt-Agar (MYA), zur Herstellung von Bacillus globigii-Sporen: Pepton aus Fleisch: 10,0 g, Hefeextrakt: 2,0 g, Mangansulfat-Monohydrat: 0,04 g, Agar: 15 g, Wasser (destilliert): 1.000 ml; - Bacillus globigii Stammkultur, zur Herstellung der Bacillus globigii Stammkulturen-Sporensuspension: Bacillus globigii (DSM 1) No. 675 [Bac. Atrophaeus]) oder Bacillus globigii (DSM 1) No. 2277 [Bac. Atrophaeus]) oder Bacillus globigii (Stammsammlung der Universität Hohenheim 2)); - Zentrifuge mit einer Beschleunigung von 10.000 g. Probenherstellung Trypton-Glucose-Bouillon (TGB): Die Bouillon wird in Portionen von je 10 oder 100ml in Prüfröhrchen gegeben. Es wird im Autoklaven sterilisiert. Nach der Sterilisation muss der pH-Wert des Mediums 7,2 (± 0,2), gemessen bei 20 °C, betragen. Hefeextrakt-Agar (MYA): Der Agar wird in Roux-Flaschen oder Petrischalen gegeben. Es wird im Autoklaven sterilisiert. Nach der Sterilisation muss der pH-Wert des Mediums 7,0 (± 0,2), gemessen bei 20 °C, betragen. Bacillus globigii Stammkulturen: Die Bacillus globigii-Stammkulturen (Glycerinkultur, Lagerungstemperatur -80 °C) werden aufgetaut und in Trypton-Glucose-Bouillon (TGB) bei 37 °C über 24 Stunden bebrütet. Aus der TGB-Bouillon werden 6 ml auf MYA-Platten übertragen; der Überstand wird abpipettiert. Die MYA-Platten werden bei 37 (± 1) °C bebrütet. Nach dem dritten Bebrütungstag wird der Zustand der Kulturen mit Hilfe einer Sporenfärbung (z. B. Racket-Färbung) beurteilt. Anschließend erfolgt eine weitere Inkubation der MYA-Platten bei 30 °C über 7 bis 10 Tage. Danach werden die Kolonien von den MYA-Platten mit 3 ml sterilem destillierten Wasser (aqua dest.) abgeschwemmt. Die gewonnene Sporensuspension wird zentrifugiert (3.000 Umdrehungen/min über 10 Minuten), der Überstand wird verworfen und das Pellet wird mit aqua dest. resuspendiert. Zur Ermittlung der Anzahl der Sporen wird die Suspension zuerst bei 75 (± 1) °C über 10 Minuten erhitzt, anschließend wird mit dem Koch'schen Oberflächenverfahren die Sporenzahl pro Milliliter Suspension festgestellt. 4.1.1.2 Durchführung der Untersuchung Der biologische Tracer wird einmalig in Form einer Sporensuspension gleichmäßig während eines Beschickungsintervalls dem Fermenter zugegeben. Es wird einer Beschickungscharge soviel Sporensuspension beigemischt, dass pro Gramm Fermenterinhalt mindestens 106 Sporen vorhanden sind. Die Konzentration der Bacillus globigii-Sporen in der Suspension ist zu kontrollieren. Nach der Zuführung der Sporensuspension erfolgt die Probennahme (Einzelprobe von ca. 1 kg) im Austrag so lange, bis der Tracer erstmals in einer Probe nachgewiesen wird, und zwar mindestens a) jede Stunde bis einschließlich der 24. Stunde, b) darauf folgend alle zwei Stunden bis einschließlich der 36. Stunde, c) darauf folgend alle 4 Stunden bis einschließlich der 48. Stunde, d) darauf folgend alle 6 Stunden. 4.1.1.3 Nachweismethode Aus den zu untersuchenden Proben werden zur Vorverdünnung 20 g in 180 ml Natriumchlorid (0,9 %-ige Kochsalzlösung) eingewogen und ca. 20 Stunden bei 4 °C auf dem Schüttler durchmischt. Nach einer ausreichenden Durchmischung wird je 1 ml der Probe in geometrischer Reihe bis zur Verdünnungsstufe 10-8 in jeweils 9 ml NaCl-Lösung pipettiert. Anschließend werden jeweils 0,1 ml jeder Verdünnungsstufe auf zwei parallele Standard-I-Agarplatten pipettiert und mit einem ausgeglühten Drahtspatel gleichmäßig verteilt (Inkubation 37 °C/24 Stunden). Ausgezählt werden auf den Nährbodenplatten nur jene Kolonien, die ein typisches orange-rotes Wachstum zeigen. 4.1.1.4 Mindestverweilzeit Die Mindestverweilzeit ergibt sich aus dem Zeitraum zwischen der Zugabe der Bacillus globigii-Sporensuspension und der letzten Probe ohne Befund vor dem erstmaligen Nachweis des biologischen Tracers im Austrag des Fermenters. 4.1.2 Traceruntersuchung mit Lithium 4.1.2.1 Vorbereitung Bestimmung der Lithium-Grundbelastung in der Abfallsuspension Zunächst ist die natürliche Lithium-Grundbelastung in der Abfallsuspension zu bestimmen. Hierzu wird vor Prüfungsbeginn mindestens 5 Tage lang täglich eine repräsentative Probe am Austrag des Fermenters entnommen und der Lithiumgehalt bestimmt. Je nach Bioabfallzusammensetzung beträgt die Grundbelastung an Lithium in der Regel zwischen 1 und 5 mg je kg Trockenmasse. Benötigte Materialien Tracer: Lithiumhydroxid-Monohydrat 4.1.2.2 Durchführung der Untersuchung Für die Untersuchung ist die Lithiumkonzentration von 50 mg/kg Trockenmasse bezogen auf den gesamten Fermenterinhalt (vollständige Durchmischung) einzustellen. Die erforderliche Lithiummenge ist abhängig vom Fermenternutzvolumen der zu überprüfenden Vergärungsanlage zur Hygienisierung. Der Tracer wird in gelöster Form während eines Beschickungsintervalls gleichmäßig dem Fermenter zugegeben. Von dieser Lithiumsuspension ist eine Rückstellprobe bis zum Vorliegen der Ergebnisse aufzubewahren. Nach der Zuführung des Tracers erfolgt die Probennahme (Einzelprobe von ca. 1 kg) im Austrag so lange, bis der Tracer erstmals in einer Probe nachgewiesen wird (Lithiumkonzentration > Grundbelastung), und zwar mindestens a) jede Stunde bis einschließlich der 24. Stunde, b) darauf folgend alle 2 Stunden bis einschließlich der 36. Stunde, c) darauf folgend alle 4 Stunden bis einschließlich der 48. Stunde, d) darauf folgend alle 6 Stunden. 4.1.2.3 Nachweismethode Zur Ermittlung der Lithiumkonzentration werden die Proben nach DIN EN ISO 11885:2009 3) analysiert. 4.1.2.4 Mindestverweilzeit Die Mindestverweilzeit ergibt sich aus dem Zeitraum zwischen der Zugabe des Lithiumtracers und der letzten Probe ohne Konzentrationserhöhung vor dem erstmaligen Nachweis des Tracers im Austrag des Fermenters. Der Tracer ist nachgewiesen, wenn die festgestellte Konzentration von Lithium die ermittelte Grundbelastung um die doppelte Standardabweichung übersteigt, die bei den gemäß Nummer 4.1.2.1 entnommenen Proben ermittelt wird. 4.2 Prüfungen der Seuchenhygiene 4.2.1 Prozessprüfung 4.2.1.1 Testorganismus und Grenzwert Die Prozessprüfung in der Seuchenhygiene wird mit dem Testkeim Salmonella senftenberg W775 (H2S-negativ) durchgeführt. Die Prozessprüfung ist in der Seuchenhygiene erfolgreich abgeschlossen, wenn in den zwei aufeinanderfolgenden Untersuchungsgängen jeweils nach dem für die Hygienisierung relevanten Verfahrensschritt in keiner Probe Salmonellen nachweisbar sind. 4.2.1.2 Einlageproben für aerobe hygienisierende Verfahren (thermophile Kompostierung) Der Testkeim Salmonella senftenberg W775 (H2S-negativ) wird in Standard-I-Bouillon bei 37 °C über 18 bis 24 Stunden inkubiert. Die so erzeugte Keimsuspension soll eine Mikroorganismenkonzentration von mindestens 107 bis 108 KBE/ml enthalten. Die Konzentration ist durch Vergleich mit einem Standard (z. B. McFarland) oder dem Oberflächenverfahren oder MPN-Verfahren (Most Probable Number) zu bestimmen. Bei der Kompostierung zur Hygienisierung wird pro Probe ca. 225 g frisches, homogenisiertes und zerkleinertes Bioabfallmaterial aus der zu überprüfenden Anlage mit 25 ml dieser Keimsuspension getränkt und anschließend in sterile Zwiebel- oder Kunststoffsäckchen verpackt. Die Einlage der Proben in das Kompostiergut erfolgt entweder in dieser Form oder in grob perforierten stabilen Probenbehältern, die für den jeweiligen Prozess geeignet sind. Nachdem der für die Hygienisierung relevante Verfahrensabschnitt durchlaufen ist, werden die Probenbehälter wieder entnommen und jeweils 50 g des homogenisierten Inhalts eines Probensäckchens in 450 ml gepuffertem Peptonwasser mit Novobiocin über 30 Minuten bei 4 °C langsam ausgeschüttelt (150 rpm) und anschließend über 22 (± 2) Stunden bei 36 (± 2) °C inkubiert. Die so erhaltene Suspensionslösung wird für die Identifizierung von Salmonellen benutzt. 4.2.1.3 Einlageproben für anaerobe hygienisierende Verfahren (thermophile Vergärung) Die Keimsuspension mit dem Testkeim Salmonella senftenberg W775 (H2S-negativ) wird hergestellt wie in Nummer 4.2.1.2 Absatz 1 beschrieben. In Vergärungsanlagen zur Hygienisierung wird jeweils 1 ml der Keimsuspension von Salmonella senftenberg W775 (H2S-negativ) mit Diffusionskeimträgern 4) in den Prozess eingeschleust. Die Diffusionskeimträger werden außer mit 1 ml der Keimsuspension auch mit 9 ml Gärrückstand angefüllt und in die für die thermische Inaktivierung relevanten Prozessabschnitte oder Anlageteile jeweils für die ermittelte Mindestverweilzeit (s. Nummer 4.1) und Hygienisierungstemperatur eingebracht. Nachdem das Verfahren durchlaufen ist, wird der jeweilige Gesamtinhalt der Diffusionskeimträger (10 ml) in 90 ml gepuffertes Peptonwasser mit Novobiocin (Voranreicherung) gegeben, kurz geschüttelt (150 rpm) und über 22 (± 2) Stunden bei 36 (± 2) °C inkubiert. Die so erhaltene Suspensionslösung wird für die Identifizierung von Salmonellen benutzt. 4.2.1.4 Nachweismethode Vorhandene Salmonellen werden mit den Suspensionslösungen identifiziert, die nach den oben beschriebenen Methoden hergestellt worden sind (s. Nummer 4.2.1.2 und 4.2.1.3). Hierzu werden jeweils 0,1 ml aus der gut durchmischten Voranreicherung in 10 ml Anreicherungsbouillon nach Rappaport bei 36 (± 2) °C und bei 42 (± 1) °C über 22 (± 2) Stunden inkubiert. Anschließend werden Parallelausstriche auf Xylose-Lysin-Desoxycholat-Agar (XLD) und einem weiteren Salmonella-Differenzial-Nährboden mit der Nachweismöglichkeit anderer biochemischer Eigenschaften als XLD-Agar angelegt. Salmonellenverdächtige Kolonien werden auf Nutrient-Agar überimpft und bei 36 (± 2) °C für 22 (± 2) Stunden inkubiert. Die Identifizierung erfolgt biochemisch oder serologisch auf Grund der Körper- und Geißelantigene (O- und H-Antigene). Zur Kontrolle der Überlebensfähigkeit (Tenazität) des Teststammes werden parallel zur Prozessprüfung vier Kontrollproben hergestellt. Diese Kontrollproben werden nicht in das Hygienisierungsverfahren eingebracht, sondern während des Prüfungszeitraums in feuchtem Sand (z. B. Eimer mit Quarzsand, Befeuchtung mit deionisiertem Wasser) bei Raumtemperatur (20 bis 25 °C) gelagert und nach Abbruch der Prozessprüfung aufgearbeitet. Mindestens drei der vier Kontrollproben sollen positive Salmonellenbefunde liefern; anderenfalls ist die Tenazität des Teststammes nicht als ausreichend anzusehen. 4.2.2 Prüfungen der hygienisierten Bioabfälle Für die Prüfung der hygienisierten Bioabfälle in der Seuchenhygiene werden aus einer gut durchmischten Sammelprobe (ca. 3 kg) jeweils 50 g Material nach der oben angegebenen Methode (s. Nummer 4.2.1.2) auf das Vorhandensein von Salmonellen untersucht. Die Sammelmischprobe setzt sich aus mindestens fünf verschiedenen Teilproben einer Charge des hygienisierend behandelten, gemäß Nummer 3.3 zu untersuchenden Materials zusammen. Die Prüfung der hygienisierten Bioabfälle ist in der Seuchenhygiene erfolgreich abgeschlossen, wenn in jeweils 50 g der entnommenen Sammelproben keine Salmonellen nachweisbar sind. 4.3 Prüfungen der Phytohygiene 4.3.1 Prozessprüfung 4.3.1.1 Testorganismen und Grenzwerte Aus der Vielzahl von Phytopathogenen und Pflanzensamen, die im Ausgangsmaterial von Bioabfallbehandlungsanlagen vorkommen, werden folgende Leit- oder Indikatororganismen in Prozessprüfungen in der Phytohygiene verwendet: a) Plasmodiophora brassicae (Kohlhernie) mit einer einwöchigen Wärmetoleranz von 50 °C, Grenzwert im Biotest: Befallsindex ≤ 0,5 je Prüfbereich, b) Tomatensamen, Grenzwert im Biotest: ≤ 2 % keimfähige Samen je Prüfbereich, c) zusätzlich bei aerober hygienisierender Behandlung (thermophile Kompostierung) gemäß Nummer 2.2.2: Tabakmosaikvirus (TMV), Grenzwert im Biotest: ≤ 4 % Restinfektiosität (Relativwert zur Positivkontrolle) je Prüfbereich. Die Prozessprüfung ist in der Phytohygiene erfolgreich abgeschlossen, wenn in den zwei aufeinanderfolgenden Untersuchungsgängen jeweils nach dem für die Hygienisierung relevanten Verfahrensschritt in den Proben je Prüfbereich die angegebenen Grenzwerte - bei den Parametern Plasmodiophora brassicae und Tomatensamen nicht überschritten sowie - bei dem Parameter Tabakmosaikvirus um nicht mehr als maximal 30 % überschritten werden. 4.3.1.2 Testorganismus Plasmodiophora brassicae Die Prozessprüfung in der Phytohygiene mit dem Testorganismus Plasmodiophora brassicae wird nach folgender beschriebener Methodik durchgeführt. 4.3.1.2.1 Herstellung der Einlageproben für aerobe hygienisierende Behandlungsverfahren (thermophile Kompostierung) Das Gallenmaterial (Infektionsmaterial mit dem Erreger Plasmodiophora brassicae) wird bis zur Herstellung der Einlageproben bei -25 °C tiefgefroren. Es ist nachweislich infektiöses, wärmetolerantes Gallenmaterial mit dem Erreger Plasmodiophora brassicae von befallenen Kohlpflanzen zu verwenden. Die Wärmetoleranz ist nachgewiesen, wenn das Gallenmaterial bei Bebrütung von 50 °C über 7 Tage eine hohe Infektiosität (Befallsgrad ≥ 2) aufweist. Jede in den Kompostierungsprozess zur Hygienisierung eingesetzte Probe enthält 30 g Gallenmaterial, 430 g Boden und 200 g des jeweiligen Kompostrohmaterials. Dies entspricht einem Verhältnis von ca. 5 % Gallenmaterial zu 65 % Boden und 30 % Kompost. Die einzelnen Probenanteile werden intensiv gemischt und in rottebeständige Beutel (Maschenweite max. 1x 1 mm) eingefüllt; dabei ist sicherzustellen, dass nichts von der Probe in den umgebenden Kompost ausgetragen wird. Entsprechend hergestellte Kontrollproben werden während des Versuchszeitraums in feuchtem, sterilisiertem Sand bei Zimmertemperatur gelagert. 4.3.1.2.2 Herstellung der Einlageproben für anaerobe hygienisierende Behandlungsverfahren (thermophile Vergärung) Für das zu verwendende Gallenmaterial (Infektionsmaterial mit dem Erreger Plasmodiophora brassicae) gilt Nummer 4.3.1.2.1 Absatz 1 entsprechend. Bei Vergärungsanlagen zur Hygienisierung werden 30 g Gallenmaterial in Gazebeutel (Maschenweite max. 1x 1 mm) in die für die thermische Inaktivierung relevanten Prozessabschnitte oder Anlageteile eingebracht. Entsprechend hergestellte Kontrollproben werden während des Versuchszeitraums in feuchtem, sterilisiertem Sand bei Zimmertemperatur gelagert. 4.3.1.2.3 Nachweis der Infektiosität durch einen Biotest Eine vorhandene Restinfektion von Plasmodiophora brassicae in den Einlageproben wird durch die nachfolgend beschriebene Prüfung festgestellt. Benötigte Materialien - Mischwanne, - Messbecher (1.000 ml), - Kunststofftöpfe (13x 13x 13 cm, ca. 1l), passende Untersetzer, - zertifiziertes Saatgut von Sarepta-Senf (Brassica juncea), - Substratdämpfer, - Sand, Körnung 0,8 - 1,2 mm (z. B. Buntsandstein mit guter Pufferkapazität, pH-Wert ca. 6,5), - Weißtorf (pH-Wert ca. 3,5), - pH-Meter, - Einmalhandschuhe (für jede Probe ein Paar), - wasserlöslicher Volldünger (fest oder flüssig). Probenaufbereitung Nach Rückgewinnung aus dem geprüften Hygienisierungsverfahren werden die Einlageproben mit dem Erreger Plasmodiophora brassicae sorgfältig zerkleinert und mit einem Sand-Torfgemisch (5 Stunden bei 80 °C gedämpft) auf ein Volumen von 1.000 ml aufgefüllt und gut homogenisiert. Da der pH-Wert einen starken Einfluss auf die Infektiosität von Plasmodiophora brassicae ausübt (Optimum: pH-Wert 6,0 ± 0,2), ist der pH-Wert der hergestellten Substratmischung zu überprüfen und gegebenenfalls durch Erhöhung des Torfanteils zu korrigieren. Biotest Als Versuchsgefäße werden 13x 13x 13 cm große Kunststofftöpfe verwendet. Für jede reisolierte Erregerprobe, die mit dem Sand-Torf-Gemisch auf je 1.000 ml aufgefüllt wurde, wird ein Gefäß mit 16 Nachweispflanzen Sarepta-Senf (Brassica juncea) angelegt; dabei werden in jedes Gefäß vorgezogene Keimpflanzen (1. Laubblattbildung) einpikiert. Der Biotest wird als randomisierter Versuch im Gewächshaus oder in einer Klimakammer bei 6.000 bis 9.000 Lux und einer Temperatur von mindestens 20 °C aufgestellt. Die Pflanzen werden ab der dritten Woche wöchentlich einmal gedüngt. Die Vegetationszeit des Biotests bis zur Bonitur der Nachweispflanzen beträgt 4 bis 5 Wochen. Nach Beendigung des Biotests wird zum einen die Anzahl der befallenen Pflanzen gezählt und zum anderen die Wurzelgallenbildung nach einer Boniturskala von 0 bis 3 bewertet: Befallsklasse | Beschreibung der Symptome 0 | Keine sichtbaren Symptome 1 | Leichte Gallenbildung an Haupt- und Nebenwurzeln 2 | Mittlere Gallenbildung an Haupt- und Nebenwurzeln 3 | Starke Gallenbildung am gesamten Wurzelsystem Bewertung der Boniturnoten Für jede einzelne Erregerprobe (Wiederholung) werden die Boniturnoten für den Befall der Einzelpflanzen (Befallsklasse = Kl) nach folgender Formel im Befallsindex zusammengefasst: 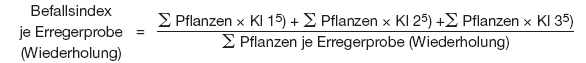 Der Befallsindex für einen Prüfbereich ergibt sich aus dem arithmetischen Mittel des Befallsindex aller Wiederholungen (Erregerproben) des jeweiligen Prüfbereichs:  Ist der Befallsindex je Prüfbereich ≤ 0,5, so ist die Prüfung bestanden. 4.3.1.3 Testorganismus Tomatensamen Die Prozessprüfung in der Phytohygiene mit dem Testorganismus Tomatensamen wird nach folgender beschriebener Methodik durchgeführt. Für die Herstellung der Einlageprobe und die Bestimmung der Keimrate durch einen Biotest werden folgende Materialien benötigt: - Kunststoff-Petrischalen mit Deckel (Ø 9 cm), - Rundfilterpapier, - Tomatensaatgut (Lycopersicon lycopersicum [L.] Karsten ex Farw.), Sorte Saint-Pierre (Synonym: San Pedro). 4.3.1.3.1 Herstellung der Einlageprobe Etwa 1 g oder 400 Tomatensamen (Lycopersicon lycopersicum [L.] Karsten ex Farw.) der Sorte Saint-Pierre (Synonym: San Pedro) werden in einen kleinen Beutel aus unverrottbarem Gazestoff (Maschenweite 1x 1 mm) gefüllt und vor dem Verschließen auf der gesamten Gazefläche verteilt, um eine möglichst geringe Schichtdicke der Tomatensamen zu erreichen. Die Keimfähigkeit der Tomatensamen muss vor den Untersuchungen bestimmt werden. Zur Prüfung darf nur Saatgut mit einer Mindestkeimfähigkeit von 90 % verwendet werden. 4.3.1.3.2 Bestimmung der Keimrate durch einen Biotest Nach Beendigung der Untersuchung wird der Testorganismus aus den Einlageproben entnommen und umgehend einer Keimfähigkeitsprüfung unterzogen. Biotest Die Tomatensamen werden aus der Einlageprobe entnommen und 200 Samen werden abgezählt. Die restlichen Samen werden 1 bis 2 Tage unter Wohnraumbedingungen (20 bis 50 % rel. Luftfeuchte, etwa 20 °C) zurückgetrocknet, luftdicht verschlossen und für etwaige Wiederholungen der Keimfähigkeitsbestimmung im Kühlschrank aufbewahrt (Rückhalteprobe). Die abgezählten Samen werden in sauberem Zustand, falls erforderlich abgewaschen, zur Keimfähigkeitsbestimmung ausgelegt, z. B. 4x 50 Samen auf 4 Lagen angefeuchtetem Filterpapier in abgedeckten Petrischalen mit 9 cm Durchmesser bei 25 °C und Belichtung in einem geeigneten Raum oder Klimaschrank. 7) Alle sieben Tage werden die gekeimten Tomatensamen so lange ausgezählt, bis keine weiteren Samen keimen. Als gekeimt gilt der Samen, bei dem die Wurzel oder der Spross sichtbar ausgetreten ist. Sind nach 21 Tagen keine Samen gekeimt, wird die Keimfähigkeitsprüfung abgeschlossen. Bewertung der Ergebnisse Die Gesamtzahl gekeimter Samen wird festgestellt und als Prozentsatz der verwendeten Samen in der geprüften Aliquote (200 Samen) angegeben. Die Keimfähigkeit der Tomatensamen für einen Prüfbereich ergibt sich aus dem arithmetischen Mittel der Keimfähigkeitsraten aller Wiederholungen (Erregerproben) des Prüfbereichs. 4.3.1.4 Testorganismus Tabakmosaikvirus bei aeroben hygienisierenden Behandlungsverfahren (thermophile Kompostierung) Die Prozessprüfung in der Phytohygiene mit dem Testorganismus Tabakmosaikvirus wird nach folgender dargestellter Methode durchgeführt. Für die Herstellung der Einlageproben und den Nachweis durch einen Biotest werden folgende Materialien und Reagenzien benötigt: - Kunststofftöpfe mit einem Volumen von 500 ml mit Bodenlochung und Unterschalen, - wasserlösliche Mehrnährstoffdünger, - Tabaksaatgut (Nicotiana tabacum 'Samsun' ), - Tabaksaatgut (Nicotiana glutinosa L.), - Einheitserde 0 (EE0) als Pflanzsubstrat, - Mörser und Pistill, - Karborund-Bentonit-Gemisch (Verhältnis 1:1), - Phosphatpuffer nach Sörensen (pH-Wert 7) oder ein entsprechendes handelsübliches Produkt, - TMV-haltige Suspension (Pflanzenpresssaft aus TMV-infizierten Tabakpflanzen), - Filtriergaze, - handelsübliche Wattestäbchen, - verschließbare Glas- oder Kunststoffgefäße, - Aufbewahrungsgefäße und Feuchteschalen. 4.3.1.4.1 Herstellung der Einlageproben Die Vermehrung des Virus erfolgt in Tabakpflanzen (Nicotiana tabacum 'Samsun' ), in denen es sich systemisch ausbreitet. Dazu werden die Tabakpflanzen bei 18 bis 22 °C unter Gewächshausbedingungen bis zum 5-Blattstadium herangezogen. Zur Inokulation werden 2 oder 3 untere Blätter mit einem Gemisch aus Karborund und Bentonit (1:1) dünn eingepudert und die TMV-haltige Suspension (Pflanzenpresssaft aus TMV-infizierten Tabakpflanzen) in 0,05 mol/l Phosphatpuffer nach Sörensen oder entsprechend (pH-Wert 7) auf die bestäubten Blätter aufgetragen. 2 bis 3 Wochen nach der Inokulation können dann virushaltige Blätter mit mosaikartigen Verfärbungen für die Untersuchungen verwendet werden. Jede in den Kompostierungsprozess zur Hygienisierung eingeschleuste Probe enthält 10 g TMV-infizierte Tabakblätter (Nicotiana tabacum 'Samsun' ), die in ein rottebeständiges Gazesäckchen (Maschenweite 1x 1 mm) gefüllt werden. Damit die Rottebedingungen auf die TMV-infizierten Tabakblätter einwirken können, ist das Gazesäckchen der Einlageprobe vollständig mit Kompostrohmaterial zu umgeben. Es sind Positivkontrollen aus 10 g mit TMV-infizierten Tabakblättern (Nicotiana tabacum 'Samsun' ) derselben Charge herzustellen, die bei -18 °C aufbewahrt werden. 4.3.1.4.2 Nachweis der Infektiosität durch einen Biotest Die Inaktivierung der durch den Hygienisierungsprozess der thermophilen Kompostierung geleiteten Erregerproben wird durch einen Biotest nach folgender beschriebener Methode untersucht. Probenaufarbeitung Nach Beendigung des hygienisierenden Verfahrensschritts (z. B. Entnahme nach Beendigung der Prozessprüfung auf einer thermophilen Kompostierungsanlage) wird die TMV-Erregerprobe von eventuell vorhandenen nicht verrotteten groben Bestandteilen befreit. Unter Zusatz von 30 ml Phosphatpuffer nach Sörensen oder entsprechend (0,05 mol/l; pH-Wert 7) wird die Probe in einem Mörser zerkleinert. Die Probensuspension wird auf die Filtriergaze gegeben und ausgepresst. Der Probenextrakt wird in ein verschließbares Glas- oder Kunststoffgefäß überführt. Mit den mitgeführten Positiv-Kontrollproben wird in gleicher Weise verfahren. Biotest Als Nachweis für die Infektion werden die Extrakte aus den Proben und aus den Kontrollen auf Blätter der Testpflanze (Nicotiana glutinosa L.) aufgetragen. Der Biotest wird an Nachweispflanzen durchgeführt, die sich im 6 - 8-Blattstadium befinden. Für die Inokulation der 12 reisolierten TMV-Erregerproben werden insgesamt 12 Nachweispflanzen benötigt, wobei je Prüfbereich vier Proben an vier Pflanzen getestet werden. An den Nachweispflanzen werden die Vegetationsspitze und die unteren älteren Blätter entfernt, so dass jeweils vier voll ausgebildete Blätter für die Inokulation an den Pflanzen verbleiben. Für die bessere Vergleichbarkeit bei Lokalläsionen an Pflanzen mit Blättern unterschiedlicher Größe und unterschiedlichen Alters ist das lateinische Quadrat als Versuchsanordnung zu wählen. Voraussetzung hierfür ist die gleiche Anzahl an TMV-Proben, Testpflanzen und Blättern. Bei der Prozessprüfung werden die drei charakteristischen Prüfbereiche des Rottekörpers in jeweils vierfacher Wiederholung überprüft. Das folgende Schema verdeutlicht die Versuchsanordnung der Halbblattmethode unter Einbeziehung der Positiv-Kontrollprobe (P) für die vier zu prüfenden TMV-Proben (A, B, C, D) eines Prüfbereichs: | Pflanze 1 | Pflanze 2 | Pflanze 3 | Pflanze 4 Blatt- position | Blatthälfte (aus Richtung Blattspitze) | Blatthälfte (aus Richtung Blattspitze) | Blatthälfte (aus Richtung Blattspitze) | Blatthälfte (aus Richtung Blattspitze) links | rechts | links | rechts | links | rechts | links | rechts 1. Blatt | A | P | P | D | C | P | P | B 2. Blatt | B | P | P | A | D | P | P | C 3. Blatt | C | P | P | B | A | P | P | D 4. Blatt | D | P | P | C | B | P | P | A Die Blätter können im Hinblick auf die durchzuführenden Behandlungen auf der Blattunterseite mit einem wasserfesten Filzstift gekennzeichnet werden. Zuerst wird immer die Untersuchungsprobe aufgetragen und anschließend die Kontrollprobe. Dann werden die Blätter der Nachweispflanzen mit einem Gemisch aus Karborund und Bentonit (1:1) dünn eingepudert. Die Proben- und Kontrollextrakte werden mit einem Wattestäbchen auf die Blätter aufgetragen, wobei die bestäubten Blatthälften mit dem Extrakt zweimal gleichmäßig mit leichtem Druck und mit Handbewegungen, die von der Mittelader zum Blattrand verlaufen, bestrichen werden. Dabei wird das Blatt mit einer Hand von der Blattunterseite her unterstützt. Sofort nach der Behandlung werden die Tabakblätter direkt am Spross abgeschnitten und die anhaftenden Karborund-/Bentonit-Reste von der Blattoberfläche mit Leitungswasser vollständig entfernt (Sprühflasche oder Brause). Für die Inkubation werden die behandelten Blätter entweder in ein mit Wasser gefülltes Gefäß gestellt oder in entsprechende Feuchteschalen gelegt. Im Anschluss werden die behandelten Blätter bis zur Symptomausbildung in eine Klimakammer oder ein klimatisiertes Gewächshaus bei 22 bis 25 °C gestellt. Während des Inkubationszeitraums werden die behandelten Blätter täglich für 16 Stunden beleuchtet (Belichtungsstärke mindestens 2.000 Lux). Spätestens 5 Tage nach der Inokulation sind die Infektionsherde in Form von nekrotischen Lokalläsionen deutlich zu erkennen. Hierbei handelt es sich um kleine runde Flecken von 2 bis 3 mm Durchmesser, deren Zentren aus abgestorbenem Gewebe bestehen. Bewertung der Ergebnisse Für die Bewertung werden die gebildeten Läsionen einer jeden Blatthälfte getrennt ausgezählt. Die Auswertung erfolgt durch Addition der Läsionen der jeweiligen vier Blatthälften, die jeweils mit der Proben- und Kontrolllösung inokuliert worden sind. Die Restinfektiosität der Erregerproben wird prozentual in Relation zur Positiv-Kontrolle ausgedrückt. Für jede einzelne Erregerprobe (Wiederholung) wird die relative Restinfektion auf vier inokulierten Tabakblättern nach folgender Formel zusammengefasst: 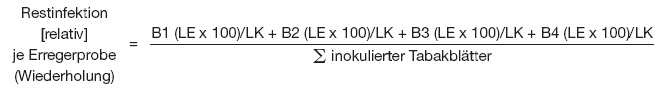 B1 = inokuliertes Blatt der ersten Pflanze B2 = inokuliertes Blatt der zweiten Pflanze B3 = inokuliertes Blatt der dritten Pflanze B4 = inokuliertes Blatt der vierten Pflanze LE = Läsionszahl der Erregerprobe LK = Läsionszahl der Positiv-Kontrollprobe Die Restinfektion [Relativwert] des Erregers Tabakmosaikvirus für einen Prüfbereich ergibt sich aus dem arithmetischen Mittel der relativen Restinfektionen aller Wiederholungen (Erregerproben) des jeweiligen Prüfbereichs:  Ist die Restinfektion [Relativwert] je Prüfbereich ≤ 4 %, so ist die Prüfung bestanden. 4.3.2 Prüfungen der hygienisierten Bioabfälle Bei der Prüfung der hygienisierten Bioabfälle in der Phytohygiene wird der Gehalt an keimfähigen Samen und austriebsfähigen Pflanzenteilen im hygienisierend behandelten Material mit der Kultivierungsmethode bestimmt. Die Prüfung wird mit Material aus einer gut durchmischten Sammelprobe (ca. 3 kg) durchgeführt. Die Sammelmischprobe setzt sich aus mindestens fünf verschiedenen Teilproben einer Charge des hygienisierend behandelten, gemäß Nummer 3.3 zu untersuchenden Materials zusammen. Probenvorbehandlung Das Volumengewicht und der Salzgehalt des Prüfsubstrats sind zu bestimmen. Bei Komposten wird die Originalprobe < 10 mm gesiebt. Zu nasse und nicht siebfähige Komposte werden vorgetrocknet (Lufttrocknung). Pasteurisierte Materialien und flüssige Gärrückstände werden ungesiebt und als flüssiges Prüfsubstrat verwendet. Benötigte Materialien - Kunststoffschalen mit Bodenlochung oder gleichwertige Versuchsbehältnisse, - Gießmatten, - Nadellochfolie, - geeignetes Mischsubstrat (z. B. schwach zersetzter Hochmoortorf mit ca. 4 g kohlensaurem Kalk pro Liter, welches frei von keimfähigen Samen und austriebsfähigen Pflanzenteilen ist). Durchführung 3l gesiebtes (FS < 10 mm) Prüfsubstrat werden für feste Proben und 0,5l flüssiges Prüfsubstrat für flüssige Proben eingesetzt. Nach Bestimmung des Salzgehaltes 9) wird das Prüfsubstrat mit einer geeigneten Mischkomponente (KCl-Gehalt = 0 g/l) so verdünnt, dass die Prüfmischung einen Salzgehalt von < 2 g KCl pro Liter aufweist. Als Mischkomponente, die frei von keimfähigen Samen und austriebsfähigen Pflanzenteilen sein muss, eignet sich Hochmoortorf mit ca. 4 g kohlensaurem Kalk pro Liter. Die Prüfmischung wird in einer Schichtdicke von ca. 10 mm in Versuchsschalen (Kunststoffschalen mit Bodenlochung oder gleichwertige Behältnisse, die mit einer Gießmatte und einer Nadellochfolie als Verschmutzungsschutz ausgelegt sind) gleichmäßig ausgebracht, leicht angedrückt und durch Gießen auf volle Wasserkapazität gebracht. Danach werden die Versuchsbehältnisse über einen Zeitraum von 15 Tagen bei einer Beleuchtungsstärke von mindestens 1.000 Lux und einer Temperatur von 18 bis 20 °C ohne direkte Sonneneinstrahlung belassen. Der Wasserverlust wird regelmäßig durch Überbrausen ausgeglichen. Um eine Austrocknung zu vermeiden, sollen die Schalen mit Glas- oder Kunststoffscheiben so abgedeckt werden, dass ein Luftaustausch weiterhin möglich ist. Berechnung Nach 15 Tagen Kulturdauer werden die aufgelaufenen Pflanzen gezählt und ihre Anzahl wird, bezogen auf einen Liter Prüfsubstrat, auf 2 Kommastellen genau angegeben. Die Prüfung der hygienisierten Bioabfälle ist in der Phytohygiene erfolgreich abgeschlossen, wenn der Gehalt an keimfähigen Samen und austriebsfähigen Pflanzenteilen maximal 2 pro Liter Prüfsubstrat ist. --- 1) DSM: Deutsche Stammsammlung für Mikroorganismen, Marscheroder Weg 1b, 38124 Braunschweig. 2) Universität Hohenheim, Institut für Umwelt- und Tierhygiene, Garbenstraße 30, 70599 Stuttgart. 3) Veröffentlicht in der Beuth-Verlag GmbH, Berlin; archivmäßig gesichert niedergelegt beim Deutschen Patent- und Markenamt in München. 4) Methode nach Schwarz, Michael, Vergleichende seuchenhygienisch-mikrobiologische Untersuchungen an horizontal und vertikal beschickten, bewachsenen Bodenfiltern mit vorgeschalteter Mehrkammerausfaulgrube bzw. einem als Grobstoff-Fang dienenden Rottebehälter (Rottefilter), S. 45, veterinärmedizinische Dissertation, FU Berlin, 2003; archivmäßig gesichert niedergelegt bei der Deutschen Nationalbibliothek in Leipzig. 5) Boniturklasse 1, 2 bzw. 3. 6) Einlagebereich bei Prozessprüfungen, z. B. Kompostierung: Rand, Kern, Basis; Vergärung: unterschiedliche Bereiche des Fermenters. 7) Methode nach 'Internationale Vorschriften für die Prüfung von Saatgut, Seed Science and Technology 21, Supplement, Internationale Vereinigung für die Prüfung von Saatgut' (ISTA - International Seed Testing Association, Hrsg.), 1993; archivmäßig gesichert niedergelegt bei der Deutschen Nationalbibliothek in Leipzig. 8) Einlagebereich bei Prozessprüfungen von Kompostierungsverfahren: Rand, Kern, Basis. 9) Methode nach Methodenbuch zur Analyse organischer Düngemittel, Bodenverbesserungsmittel und Substrate, Kapitel III. C 2, Bundesgütegemeinschaft Kompost e. V. (Hrsg.), 5. Auflage 2006, Selbstverlag, Köln; archivmäßig gesichert niedergelegt bei der Deutschen Nationalbibliothek in Leipzig. |
Anzeige
Link zu dieser Seite: https://www.buzer.de/gesetz/3518/al33757-0.htm
Menü: Normalansicht
| Start
| Suchen
| Sachgebiete
| Aktuell
| Verkündet
| Web-Plugin
| Über buzer.de
| Qualität
| Kontakt
| Support
| Werbung
| Datenschutz, Impressum
informiert bleiben: Änderungsalarm | Web-Widget | RSS-Feed
informiert bleiben: Änderungsalarm | Web-Widget | RSS-Feed


