Tools:
Update via:
Synopse aller Änderungen der DIMDIV am 29.07.2014
Diese Gegenüberstellung vergleicht die jeweils alte Fassung (linke Spalte) mit der neuen Fassung (rechte Spalte) aller am 29. Juli 2014 durch Artikel 5 der MPAVEV geänderten Einzelnormen. Synopsen für andere Änderungstermine finden Sie in der Änderungshistorie der DIMDIV.Hervorhebungen: alter Text, neuer Text
Änderung verpasst?
| DIMDIV a.F. (alte Fassung) in der vor dem 29.07.2014 geltenden Fassung | DIMDIV n.F. (neue Fassung) in der am 29.07.2014 geltenden Fassung durch Artikel 5 V. v. 25.07.2014 BGBl. I S. 1227 |
|---|---|
Gliederung | |
(Textabschnitt unverändert) § 1 Anwendungsbereich | |
| (Text alte Fassung) § 2 Elektronische Anzeigen und Anträge | (Text neue Fassung) § 2 Elektronische Anzeigen, Anträge und Unterrichtungen |
§ 3 Zentrales Erfassungssystem zur Entgegennahme von Anzeigen nach dem Medizinproduktegesetz § 3a Zentrales Erfassungssystem für Anzeigen und Anträge bei klinischen Prüfungen und Leistungsbewertungsprüfungen § 4 Medizinprodukte-Datenbanken § 5 Nutzung der Datenbanken § 6 Datenschutz und Datensicherheit § 7 Speicherungsfrist § 8 Auskunftsrecht § 9 (aufgehoben) § 10 (aufgehoben) | |
| Anlage 1 (zu § 4 Abs. 1 Nr. 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Abs. 2 MPG General Obligation to Notify pursuant to §§ 25 and 30 (2) Medical Devices Act, MPG Anlage 2 (zu § 4 Abs. 1 Nr. 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Abs. 2 MPG General Obligation to Notify pursuant to §§ 25 and 30 (2) Medical Devices Act, MPG Anlage 3 (zu § 4 Abs. 1 Nr. 2) Informationen über Bescheinigungen nach § 18 MPG Information relating to Certificates pursuant to § 18 Medical Devices Act, MPG Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG/Clinical Investigation/Performance Evaluation according to §§ 20 - 24 Medical Devices Act, MPG Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten/Notice on the Classification of a Medical Device or Demarcation from other Products | Anlage 1 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG Anlage 2 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG Anlage 3 (zu § 4 Absatz 1 Nummer 2) Informationen über Bescheinigungen nach § 18 MPG Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten |
Anlage 6 (aufgehoben) | |
§ 2 Elektronische Anzeigen und Anträge | § 2 Elektronische Anzeigen, Anträge und Unterrichtungen |
(1) Anzeigen nach den §§ 25 und 30 Absatz 2 des Medizinproduktegesetzes sind im Wege der Datenübertragung über das zentrale Erfassungssystem bei dem Deutschen Institut für Medizinische Dokumentation und Information nach den Anlagen zu dieser Verordnung vorzunehmen. (2) Absatz 1 gilt entsprechend für 1. Anzeigen nach § 18 Absatz 3 Nummer 1, § 22c Absatz 1 sowie § 23a des Medizinproduktegesetzes sowie nach § 8 Absatz 2 Satz 1 der Verordnung über klinische Prüfungen von Medizinprodukten, 2. Anträge nach § 22 Absatz 1 Satz 1, § 22a Absatz 1 Satz 1, § 22c Absatz 2 und § 24 des Medizinproduktegesetzes sowie nach § 7 Absatz 1 und § 8 Absatz 2 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten. | |
| | (2a) Zur Übermittlung von Unterrichtungen aus dem datenbankgestützten Informationssystem im Rahmen der Verfahren nach den Absätzen 1 und 2 halten die Beteiligten die elektronischen Postfächer empfangsbereit, die gegenüber dem Deutschen Institut für Medizinische Dokumentation und Information für den Austausch im Informationssystem benannt wurden. Unterrichtungspflichten innerhalb des Informationssystems gelten als erfüllt, wenn die Unterrichtung an das entsprechende elektronische Postfach versendet wurde. |
(3) Für die Bezeichnung von Medizinprodukten ist eine vom Deutschen Institut für Medizinische Dokumentation und Information mittels des zentralen Erfassungssystems vorgegebene Nomenklatur zu verwenden. Die technischen Modalitäten der Datenerfassung und -übermittlung veröffentlicht das Deutsche Institut für Medizinische Dokumentation und Information auf seiner Internetseite. | |
§ 4 Medizinprodukte-Datenbanken | |
(1) Das Deutsche Institut für Medizinische Dokumentation und Information betreibt folgende Datenbanken: 1. Datenbank mit den Inhalten der Anlagen 1 und 2 zu dieser Verordnung über a) Anzeigen nach § 25 des Medizinproduktegesetzes und b) Anzeigen nach § 30 Abs. 2 des Medizinproduktegesetzes, 2. Datenbank mit dem Inhalt der Anlage 3 zu dieser Verordnung über Bescheinigungen der Benannten Stellen nach § 18 Abs. 3 Nr. 1 des Medizinproduktegesetzes, 3. Datenbank mit dem Inhalt der Anlage 4 zu dieser Verordnung über klinische Prüfungen und Leistungsbewertungsprüfungen nach den §§ 20 bis 24 des Medizinproduktegesetzes, 4. Datenbank mit dem Inhalt der Anlage 5 zu dieser Verordnung über Mitteilungen zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu anderen Produkten nach § 33 Abs. 2 Nr. 2 in Verbindung mit § 13 des Medizinproduktegesetzes, | |
| 5. Datenbank zum Medizinprodukte-Beobachtungs- und -Meldesystem mit den Daten nach § 29 Abs. 1 Satz 5 des Medizinproduktegesetzes; sie enthält die Informationen über Meldungen und den Abschluss und das Ergebnis der durchgeführten Risikobewertungen zur Erfüllung der Verpflichtungen nach § 20 Abs. 1 Satz 1 und § 22 Abs. 2 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung vom 24. Juni 2002 (BGBl. I S. 2131), die durch Artikel 3 des Gesetzes vom 29. Juli 2009 (BGBl. I S. 2326) geändert worden ist, sowie die Mitteilungen, die die zuständigen Bundesoberbehörden nach § 21 Abs. 1 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung übermitteln oder nach § 21 Abs. 2 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung erhalten. | 5. Datenbanken zum Medizinprodukte-Beobachtungs- und -Meldesystem mit den Daten nach § 29 Absatz 1 Satz 5 des Medizinproduktegesetzes; sie enthalten die Informationen über a) Meldungen zu Vorkommnissen und Rückrufen gemäß § 3 Absatz 1 bis 4 der Medizinprodukte-Sicherheitsplanverordnung, den Abschluss und das Ergebnis der durchgeführten Risikobewertungen sowie die Mitteilungen, die die zuständigen Bundesoberbehörden nach § 21 Absatz 1 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung übermitteln oder nach § 21 Absatz 2 Satz 1 der Medizinprodukte-Sicherheitsplanverordnung erhalten, und b) Meldungen zu schwerwiegenden unerwünschten Ereignissen während klinischer Prüfungen oder Leistungsbewertungsprüfungen von In-vitro-Diagnostika gemäß § 3 Absatz 6 der Medizinprodukte-Sicherheitsplanverordnung sowie den Abschluss und das Ergebnis der durchgeführten Risikobewertungen. |
(2) Das Deutsche Institut für Medizinische Dokumentation und Information kann national und international zugängliche Datenbanken, die Informationen über Medizinprodukte enthalten, zur Nutzung aufbereiten und bereitstellen. | |
§ 5 Nutzung der Datenbanken | |
| (1) Neben den Bundesministerien der Verteidigung und für Gesundheit sind die für das Medizinprodukterecht, das Atomrecht und das Eich- und Messwesen zuständigen Behörden des Bundes und der Länder berechtigt, Daten aus den Datenbanken nach § 4 Abs. 1 entgeltfrei abzurufen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinproduktegesetzes erforderlich ist. (2) Die Benannten Stellen sind berechtigt, die Datenbank nach § 4 Abs. 1 Nr. 2 in Bezug auf eingeschränkte, verweigerte, ausgesetzte, wieder eingesetzte, zurückgezogene oder durch den Hersteller gekündigte Bescheinigungen entgeltfrei zu nutzen. (2a) Die nach § 22 Absatz 1 des Medizinproduktegesetzes zuständigen Ethik-Kommissionen und die nach § 3 Absatz 1 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten beteiligten Ethik-Kommissionen sind berechtigt, die Datenbank nach § 4 Absatz 1 Nummer 3 entgeltfrei zu nutzen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinproduktegesetzes erforderlich ist. (3) Die Datenbanken nach § 4 Abs. 1 Nr. 1 Buchstabe a und Abs. 2 sind öffentlich. Benannte Stellen können die Datenbank nach § 4 Abs. 1 Nr. 1 Buchstabe a entgeltfrei nutzen. | (1) Neben dem Bundesministerium der Verteidigung und dem Bundesministerium für Gesundheit sind die für das Medizinprodukterecht, das Atomrecht und das Eich- und Messwesen zuständigen Behörden des Bundes und der Länder berechtigt, Daten aus den Datenbanken nach § 4 Absatz 1 entgeltfrei abzurufen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinprodukterechts erforderlich ist. (2) Die Benannten Stellen sind berechtigt, die Datenbanken nach 1. § 4 Absatz 1 Nummer 1 Buchstabe a, 2. § 4 Absatz 1 Nummer 2 in Bezug auf eingeschränkte, verweigerte, ausgesetzte, wieder eingesetzte, zurückgezogene, gefälschte oder durch den Hersteller gekündigte Bescheinigungen und 3. § 4 Absatz 1 Nummer 5 Buchstabe a, soweit Vorkommnisse mit Produkten betroffen sind, zu denen sie eine Bescheinigung ausgestellt haben, entgeltfrei zu nutzen. (3) Die nach § 22 Absatz 1 des Medizinproduktegesetzes zuständigen Ethik-Kommissionen und die nach § 3 Absatz 1 Satz 4 der Verordnung über klinische Prüfungen von Medizinprodukten beteiligten Ethik-Kommissionen sind berechtigt, die Datenbanken nach § 4 Absatz 1 Nummer 3 und 5 Buchstabe b entgeltfrei zu nutzen, soweit dies zur Wahrnehmung ihrer Aufgaben beim Vollzug des Medizinproduktegesetzes erforderlich ist. (4) Die Datenbanken nach § 4 Absatz 1 Nummer 1 Buchstabe a und Absatz 2 sind öffentlich. |
§ 7 Speicherungsfrist | |
| Daten in den Datenbanken nach § 4 Abs. 1 stehen nach der letzten Änderung des jeweiligen Datensatzes noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht. | (1) Daten in der Datenbank nach § 4 Absatz 1 Nummer 1 stehen nach der Einstellung des Inverkehrbringens noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht. (2) Daten in den Datenbanken nach § 4 Absatz 1 Nummer 2 bis 5 stehen nach der letzten Änderung des jeweiligen Datensatzes noch 20 Jahre in der Datenbank zur Verfügung. Nach Ablauf dieser Frist werden die Daten gelöscht. |
Anlage 1 (zu § 4 Abs. 1 Nr. 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Abs. 2 MPG General Obligation to Notify pursuant to §§ 25 and 30 (2) Medical Devices Act, MPG | Anlage 1 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG |
| Formblatt für Medizinprodukte, außer In-vitro-Diagnostika Form for Medical Devices except In Vitro Diagnostic Medical Devices Formblatt und Erläuterungen dazu siehe BGBl. I 2007, S. 1069ff |       |
Anlage 2 (zu § 4 Abs. 1 Nr. 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Abs. 2 MPG General Obligation to Notify pursuant to §§ 25 and 30 (2) Medical Devices Act, MPG | Anlage 2 (zu § 4 Absatz 1 Nummer 1) Allgemeine Anzeigepflicht nach §§ 25 und 30 Absatz 2 MPG |
| Formblatt für In-vitro-Diagnostika Form for In Vitro Diagnostic Medical Devices Formblatt und Erläuterungen dazu siehe BGBl. I 2007, S. 1074ff |      |
Anlage 3 (zu § 4 Abs. 1 Nr. 2) Informationen über Bescheinigungen nach § 18 MPG Information relating to Certificates pursuant to § 18 Medical Devices Act, MPG | Anlage 3 (zu § 4 Absatz 1 Nummer 2) Informationen über Bescheinigungen nach § 18 MPG |
| Formblatt und Erläuterungen dazu siehe BGBl. I 2007, S. 1079ff |     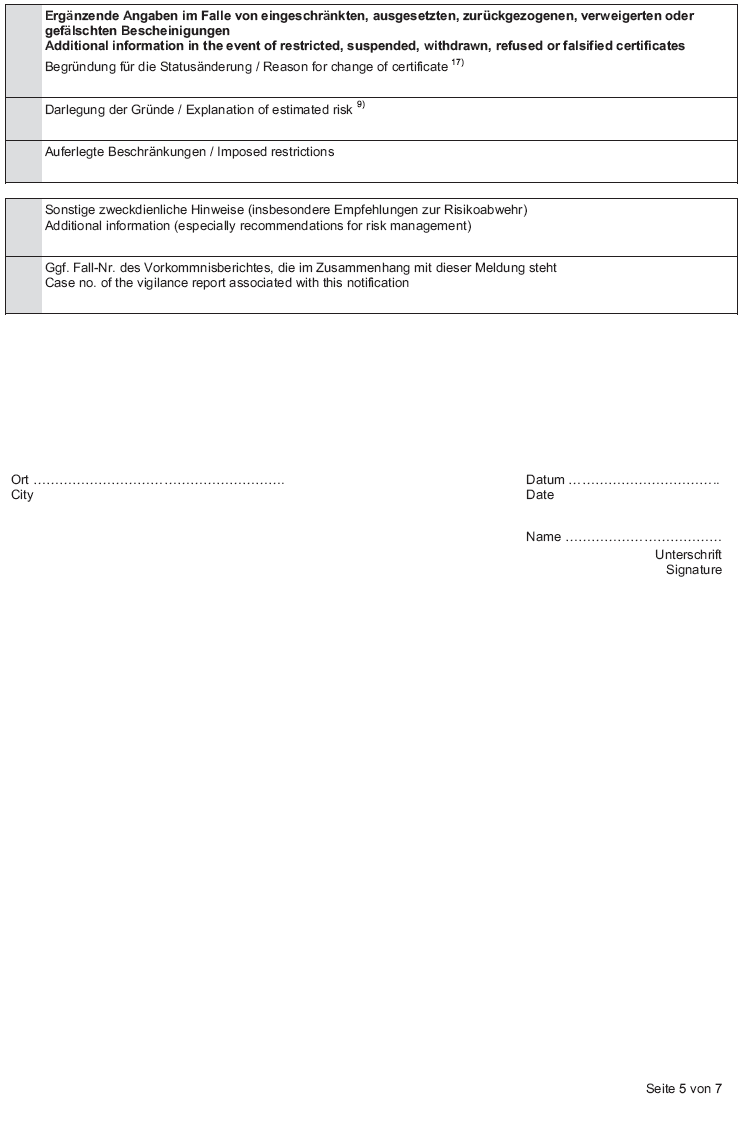   |
Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG/Clinical Investigation/Performance Evaluation according to §§ 20 - 24 Medical Devices Act, MPG | Anlage 4 (zu § 4 Absatz 1 Nummer 3) Klinische Prüfung/Leistungsbewertungsprüfung nach den §§ 20 bis 24 MPG |
| Formblatt und Erläuterungen dazu siehe BGBl. I 2010, S. 544 - 550 |          |
Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten/Notice on the Classification of a Medical Device or Demarcation from other Products | Anlage 5 (zu § 4 Absatz 1 Nummer 4) Mitteilung zur Klassifizierung eines Medizinproduktes bzw. Abgrenzung zu Nicht-Medizinprodukten |
Formblatt und Erläuterungen dazu siehe BGBl. I 2010, S. 551 - 554 |     |
Link zu dieser Seite: https://www.buzer.de/gesetz/4916/v188505-2014-07-29.htm


